随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在485℃时,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应合成甲醇:
(1)请完成CO2和3mol H2反应合成甲醇的热化学方程式:
CO2(g)+3H2(g)  CH3OH(g)+______( ),△H=-49.0kJ/mol
CH3OH(g)+______( ),△H=-49.0kJ/mol
(2)测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)= ___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③据图中提供的数据计算在该温度下的K值。要有计算过程。(保留三位有效数字)
(3)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)
A.容器中压强不变的状态 B.混合气体中c(CO2)不变的状态
C.V逆(H2O)="3" V正(H2) D.混合气体的密度保持不变的状态
E.用CO2、H2、CH3OH的物质的量浓度变化表示的反应速率的比为1:3:1的状态
F.混合气体的平均相对分子质量不再改变的状态
(4)下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
某双原子分子构成的气体,其摩尔质量为Mg/mol,该气体质量为mg,阿伏加德罗常数为NA,则:
(1) 该气体的物质的量为mol
(2) 该气体的一个分子的质量为g
(3) 该气体在标准状况下的密度为g/L
(4) 该气体所含原子总数为个
(1) 3.01×1024个OH-的物质的量为 ___,质量为 _______,这些OH-与标准状况下L NH3的物质的量相等,如果这些OH-自2L的Ba(OH)2溶液,则该Ba(OH)2的物质的量浓度为。
(2)同温同压同体积的氨气(NH3)和硫化氢(H2S)气体的质量之比为_____________,所含电子数之比为____________,相同质量的氨气和硫化氢气体的分子数之比为__________密度之比为______________,。
某混合溶液中可能含有的离子如下表所示:
| 可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH 、Fe3+ 、Fe3+ |
| 可能大量含有的阴离子 |
Clˉ、Brˉ、Iˉ、CO32ˉ、AlO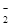 |
为探究其成分,进行了以下探究实验。
(1)探究一:
溶液的体积(V)的关系如下图所示。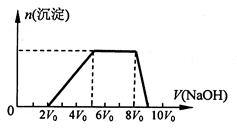
①该溶液中一定不存在的阳离子是______________ ,一定不存在的阴离子是__________;
②请写出沉淀减少过程中发生反应的离子方程式_____________________________。
(2)探究二:
乙同学检测到该溶液中含有大量的Clˉ、Brˉ、Iˉ,若向1 L该混合溶液中通入一定量的Cl2,溶液中Clˉ、Brˉ、Iˉ的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) |
11.2 L |
22.4 L |
28.0 L |
| n (Clˉ) |
2.5 mol |
3.5 mol |
4.0 mol |
| n (Brˉ) |
3.0 mol |
2.5mol |
2.0 mol |
| n (Iˉ) |
x mol |
0 |
0 |
①当起始至通入Cl2的体积为22.4L时,溶液中发生反应总的离子方程式为 ________________ ;
②原溶液中Clˉ、Brˉ、Iˉ的物质的量浓度之比为______________________。
某无色溶液,其中可能存在的离子有:Na+、Ag+、Fe3+、Ba2+、Al3+、AlO2-、S2-、SO32-、SO42-,现取该溶液进行实验,实验结果如下:
(1)生成沉淀甲的离子方程式为
(2)由溶液甲生成沉淀乙的离子方程式为;;试写出气体乙的结构式:;
(3)沉淀丙可能是;(填化学式)。
(4)综合上述信息,可以肯定存在的离子有 ;
(12分) X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的氢化物具有相同的电子数。在中学范围内X的单质只有氧化性,且是空气的主要成份之一。
(1)写出实验室制取W2反应的离子方程式。
(2)某小组设计如图所示的装置,分别研究YX2和W2的性质。
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”);若装置D中装的是铁粉,当通入足量W2时观察到的现象为;若装置D中装的是五氧化二钒,
当通入足量YX2时,打开K通入适量X2,化学反应方程式为;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,再向该试管中加入过量的下列溶液也无沉淀生成的是 (填字母)。
| A.氨水 | B.稀盐酸 | C.稀硝酸 | D.氯化钙 E.双氧水 F.硝酸银 |