运用化学反应原理研究部分单质及其化合物的反应有重要意义。
 (1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g)
(1)氨是氮循环过程中的重要物质,是氮肥工业的重要原料。氨的合成目前普遍使用的人工固氮方法:N2(g)+3H2(g) 2NH3(g)。请回答:
2NH3(g)。请回答:
①已知:H-H键能为436kJ/mol,N N键能为945kJ/mol,N一H键能为391kJ/mol.由键能计算消耗1molN2时的△H=_________。若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡_______移动(填“向左”、“向右”或“不”);
②如图中:当温度由T1变化到T2时,KA______KB(填“>”、“<”或“=”)。
(2)氨气溶于水得到氨水。NO2可用氨水吸收生成NH4NO3,25℃时,将amolNH4NO3溶于水,溶液显酸性,原因是___________(用离子方程式表示),向该溶液滴加bL氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将__________(填“正向”、“不”或“逆向”)移动,所滴加氨水的浓度为________mol/L(用含a、b的代数式表示),(NH3·H2O的电离平衡常数取Kb=2×10-5mol/L)
(3)硫酸生产中,SO2催化氧化生成SO3:SO2(g)+1/2O2(g) SO3(g)△H<0,是工业上生产硫酸的关键步骤。
SO3(g)△H<0,是工业上生产硫酸的关键步骤。
①在某温度时,该反应的平衡常数K=0.75,若在此温度下,向100L的恒容密闭容器中,充入3mol SO2、4mol O2和4mol SO3,则反应开始时正反应速率________逆反应速率(填“<”、“>”或“=”)。
②在①中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________。
a.保持温度和容器体积不变,充入1.0mol SO3(g)
b.保持温度和容器内压强不变,充入2.0mol He
c.降低温度
d.在其他条件不变时,减小容器的容积
③由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种 沉淀共存时, =_________。
=_________。
[已知该温度时,Ksp(BaSO4)=1.3×10-10,Ksp(BaCO3)=5.2×10-9]
下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制取X的主要反应之一。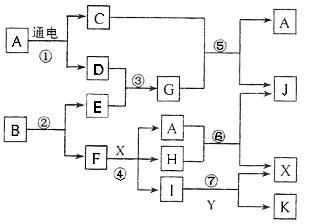
 请按要求填空:(1)写出A的电子式、F元素在周期表位置(2)反应⑤的化学方程式为:。
请按要求填空:(1)写出A的电子式、F元素在周期表位置(2)反应⑤的化学方程式为:。
(3)常温下,G和X反应生成Z,写出0.1mol/L Z溶液中离子浓度由大到小的顺序是。
(4)1mol B通过反应②得到1mol F,B中F的质量分数为72%,则B的化学式为。
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知2SO2(g)+ O2(g)  2SO3(g)
2SO3(g) 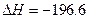 kJ·mol
kJ·mol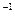 )
)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
2mol SO2、1mol O2 |
2mol SO3 |
4mol SO3 |
SO3的浓度(mol· L L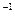 ) ) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出akJ |
吸收bkJ |
吸收ckJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
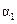 |
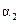 |
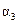 |
(1)根据上表下列说法正确的是
A.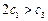 B.
B.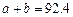 C.
C.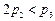 D.
D.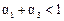
(2)甲容器中的进行反应的平衡常数表达式。
(3)甲容器平衡时SO2的转化率(用含有a的代数式表示)
(4)关于2SO2(g)+ O2(g)  2SO3(g)下列说法正确的是
2SO3(g)下列说法正确的是
A.保持容器等温等压状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
B.平衡时,测得 SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
SO2的转化率为12. 5%,O2的转化率为25%, 开始充入容器中的SO2、O2物质的量之比为4∶1
C.反应混合物中,SO3的质量分数不再改变时反应处于平衡
D.保持容器等温等容状态,待反应平衡后,再加1mol SO3重新平衡,SO3体积分数小于原平衡
(1)(6 分)已知在2L的容器中进行下列可逆反应,各物质的有关数据如下 :
: aA (g)+ bB (g)
aA (g)+ bB (g)  2C(g)
2C(g)  起始物质的量(mol): 320
起始物质的量(mol): 320
2s末物质的量浓度(mol/L): 0.9 0.8 0.4
则①a=,b=;
②2S内B的反应速率=。
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求:
③有个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为(不考虑溶液体积变化)。
(3)将2.3g金属钠放入足量的mg重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是(用含m的代数式表示)。
A、B、C三个烧杯中分别盛有200mL相同物质的量浓度的 稀硫酸
稀硫酸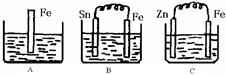
(1)分别写出三个装置中铁片表面发生反应的离子方程式:
A;B;C。
(2)一段时间后,B中Sn极附近溶液的pH(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了3.36L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度= mol·L-1。此时,三个烧杯中液体质量由大到小的顺序为:(填写序号) 。
(4)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是(填写序号)。
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:
(1)该反应的化学方程式为。
(2)反应开始至2min,以气体Z表示的平均反应速率为。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时 ____________(填“增大”“减小”或“相等”)。