下列叙述正确的是( )
| A.常温下将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B.常温下溶液中由水电离出的c(H+)= 10-5mol/L时,溶质可能是酸或碱 |
| C.常温下pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,溶液呈碱性 |
| D.向醋酸钠稀溶液中加醋酸钠固体,c(CH3COO-)/ c(Na+)增大 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为()
| A.两种分子中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152,原子核外的电子数为63。下列叙述中错误的是()
| A.它是副族元素 |
| B.它是第六周期元素 |
| C.它的原子核内有63个质子 |
D.它的一种同位素的核内有89 个中子 个中子 |
关于氢键,下列说法正确的是()
| A.每一个水分子内含有两个氢键 |
| B.冰、液氨和溴苯中都存在氢键 |
| C.分子间形成的氢键使物质的熔点和沸点升高 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
下列气态中性基态原子的第一电离能最大的是()
| A.1s22s22p63s23p2 |
| B.1s22s22p63s23p3 |
| C.ls22s22p63s23p4 |
| D.1s22s22p63s23p64s24p2 |
在乙烯分子中有5个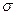 键、一个π键,它们分别是()
键、一个π键,它们分别是()
A.sp2杂化轨道形成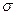 键、未杂化的2p轨道形成π键 键、未杂化的2p轨道形成π键 |
B.sp2杂化轨道形成π键、未杂化的2p轨道形成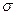 键 键 |
C.C—H之间是sp2形成的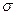 键,C-C之间是未杂化的2p轨道形成的π键 键,C-C之间是未杂化的2p轨道形成的π键 |
D.C—C之间是sp2形成的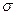 键,C-H之间是未杂化的2p轨道形成的π键 键,C-H之间是未杂化的2p轨道形成的π键 |