水的电离过程为H2O H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为Kw(25℃)=1.0×10-14,Kw(35℃)=2.1×10-14。则下列叙述正确的是
| A.c(H+)随着温度升高而降低 | B.在35℃时,c(H+)>c(OH-) |
| C.蒸馏水中通HCl,Kw增大 | D.水的电离是吸热的 |
下列变化中可以说明SO2具有漂白性的是
| A.SO2通入酸性高锰酸钾溶液中红色褪去 |
| B.SO2通入品红溶液红色褪去 |
| C.SO2通入溴水溶液中红棕色褪去 |
| D.SO2通入氢氧化钠与酚酞的混合溶液红色褪去 |
下列关于化学键的说法中正确的是
| A.构成单质分子的微粒一定含有共价键 |
| B.非极性键只存在于双原子单质分子里 |
C. 由非金属组成的化合物不一定是共价化合物 由非金属组成的化合物不一定是共价化合物 |
| D.不同元素组成的多原子分子里的化学键一定是极性键 |
某二价阳离子含24个电子,它的质量数为59,则该离子核内中子数是
| A.22 | B.26 | C.33 | D.35 |
下列各组物质关系中,与O2和O3关系相同的一组是
| A.Na和Na+ | B.金刚石和石墨 | C.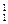 H和 H和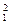 H H |
D.水和重水 |
酸雨形成的主要原因是人们向空气中排放了大量的
| A.二氧化硫 | B.二氧化碳 | C.一氧化碳 | D.硫化氢 |