对于下列氧化还原反应,请按要求填空。
(1)Cu + 4HNO3(浓) ="== " Cu(NO3)2 + 2NO2↑ + 2H2O
①用单线桥法标出电子转移的方向和数目
②氧化剂____________氧化产物_____________
③离子方程式:____________________________________________
(2)2H2S + SO2 ="== " 3S↓ + 2H2O
①用双线桥法标出电子转移的方向和数目
②若氧化产物比还原产物多1.6g,则反应中电子转移的个数为________________
(1)已知:M(g)+N(g) P(g)+W(g)ΔH>0,请回答下列问题:
P(g)+W(g)ΔH>0,请回答下列问题:
①若要增大M的转化率,在其它条件不变的情况下可以采取的措施为。
A、加入一定量M
B、加入一定量N
C、反应温度升高
D、缩小容器体积
E、加入某物质作催化剂
F、分离出一定量P
②在某温度下,反应物的起始浓度分别为:c(M)=" 1" mol·L-1,c(N)="2.4" mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为。
③若反应温度不变,反应物的起始浓度分别为:c(M)=" 4" mol·L-1,c(N)="a" mol·L-1;达到平衡后,c(P)="2" mol·L-1,a=。
(2)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________。
②下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离D.再充入1mol CO2和3mol H2
③ a.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1277 kJ·mol-1
b.2CO(g)+O2(g)=2CO2(g)ΔH=-566 kJ·mol-1
c.C(s)+1/2O2(g)=CO(g)ΔH=-110.5 kJ·mol-1
d.H2O(g)=H2O(l)ΔH=-44 kJ·mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=________。
在某一容积为2L的密闭容器内,加入0.8mol的H2和0.6mol的I2,在一定的条件下发生如下反应:H2(g)+ I2(g) 2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
2HI(g) ΔH<0。反应中各物质的浓度随时间变化情况如图1:
(1)该反应的化学平衡常数表达式为。
(2)根据图1数据,反应开始至达到平衡时,平均速率v(HI)为。
(3)反应达到平衡后,第8分钟时:
①若升高温度,化学平衡常数K(填写增大、减小或不变),HI浓度的变化正确的是(用图2中a-c的编号回答)。
②若加入I2,则H2浓度的变化正确的是(用图2中d-f的编号回答)。
A、B、C、D、E、F、G是原子序数依次增大的短周期元素,其中A与E、D与G同主族,且D与G核内质子数之和是A与E核内质子数之和的2倍,A与B、C、D可分别形成10电子分子,E、F、G元素最高价氧化物对应水化物之间可相互发生反应,请回答下列问题:
(1)B在元素周期表中的位置是。
(2)在以上元素形成的最高价氧化物的水化物中,酸性最强的化合物的分子式是。
E、F元素最高价氧化物对应水化物之间反应的离子方程式为。
(3)E在D2中燃烧生成化合物X,则X的电子式是:。
某化学小组用下图装置电解CuCl2溶液制少量漂白液: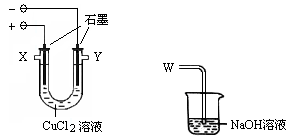
(1)其阳极的反应式是:;导气管W端应与出气口连接。
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质。某化学兴趣小组查阅资料可知:
| 物质名称及化学式 |
氯化亚铜CuCl |
碱式氯化铜Cu2(OH)3Cl |
| 性质 |
白色固体、不溶水 |
绿色固体、不溶水 |
化学小组分析提出:①红色物质可能有Cu或Cu2O、或二者都有;②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g ,并将其放入下图所示装置b中,进行实验。
实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g 。
①碳棒上的红色物质是,无水硫酸铜的作用是;
②d中反应的离子方程式是;
③装置b中发生反应的化学方程式是。
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为。
⑤阴极上产生白色物质的物质的量是;若装置b冷却时不继续通H2,则计算所得CuCl的产率会(偏大、偏小、不变)。
(1)氨在国民经济中占有重要地位。
工业合成氨的反应原理为:N2(g)+ 3H2(g) 2NH3(g)△H="―92.4" kJ·mol-1。
2NH3(g)△H="―92.4" kJ·mol-1。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q184.8 kJ(填“>”、“<”或“=”)。
②已知:
1mol N—H键断裂吸收的能量为kJ。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(H2)=mol·L-1·min-1,该温度下反应的平衡常数K =。欲增大氮气的平衡转化率,可采取的措施有(写一种措施即可)。
(2)某课外小组用下图所示装置对电解原理进行实验探究。用下图所示装置进行实验。实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。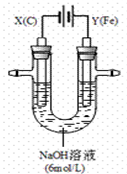
① 电解过程中,X极区溶液的pH(填“增大”、“减小”或“不变”)。
② 电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-="=" FeO42-+4H2O和。
③ 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少g。
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2,该电池正极发生的反应的电极反应式为。