已知:
(1)Zn(s)+1/2O2(g)=ZnO(s), △H=-348.3kJ/mol
(2)2Ag(s)+1/2O2(g)=Ag2O(s), △H=-31.0KJ/mol
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
| A.-317.3kJ/mol | B.-379.3kJ/mol |
| C.-332.8kJ/mol | D.+317.3 kJ/mol |
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。己知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行: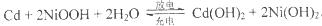
有关该电池的说法正确的是
| A.充电过程是化学能转化为电能的过程 |
B.充电对阳极反应: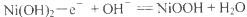 |
| C.放电时负极附近溶液的碱性不变 |
| D.放电时电解质溶液中的OH-向正极移动 |
下列叙述正确的是
A.0.1 mol/LNaClO溶液中: |
| B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小 |
| C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水电离出的c(H+)相等 |
| D.在少量Na2S的饱和溶液中加入一定量的AgCl固体,溶液中C(S2-)下降 |
已知 表示阿伏加德罗常数的值,下列叙述不正确的是
表示阿伏加德罗常数的值,下列叙述不正确的是
| A.氯化铁溶液加热蒸干最终得不到氯化铁固体 |
| B.镀锡的铁制品,镀层部分受损后,露出的铁表面更易被腐蚀 |
C.电解精炼铜时,每转移2 mol电子阳极上溶解的铜原子数为 |
D.在lL0.lmol 碳酸钠溶液中,阴离子总数大于0.1 碳酸钠溶液中,阴离子总数大于0.1 |
在下列给定条件的溶液中,一定能大量共存的离子组是
A.由水电离的c(H+)=lxl0 mol/L的溶液中: mol/L的溶液中: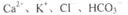 |
B.能使pH试纸呈红色的溶液; |
C. =0.1mol/L的溶液: =0.1mol/L的溶液: |
D.FeCl2溶液: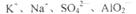 |
合成氨反应为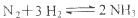 ,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)
,今有A、B、C、D四个容器,每个容器中有两种操作,两种操作分别达到平衡后,操作1中N2和操作2中NH3转化率之和一定不为1的是(起始体积相等)
A.恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3
B.恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加2 mol NH3
C.恒温恒容:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3
D.恒温恒压:操作1:加1 mol N2+3 molH2,操作2:加3 mol NH3