钢铁生产中的尾气易造成环境污染,清洁生产工艺可消减污染源并充分利用资源。已知: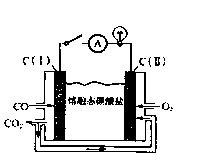
①3Fe2O2(s)+CO(g) 2Fe3O2(s)+CO2(g) △H=—47kJ/mol
2Fe3O2(s)+CO2(g) △H=—47kJ/mol
②Fe3O3(s)+3CO(g)  2Fe(s)+3CO2(g) △H=—25kJ/mol
2Fe(s)+3CO2(g) △H=—25kJ/mol
③Fe3O\4(s)+CO(g)  3FeO(s)+CO2(g) △H=+19kJ/mol
3FeO(s)+CO2(g) △H=+19kJ/mol
(1)试计算反应:FeO(s)+CO(g) Fe(s)+CO2(g)的△H= 。已知1092℃该反应的平衡常数为0.357,则1200℃时该反应的平衡常数 0.357(填“>”“=”或“<”),在1L的密闭容器中,投入7.2gFeO和0.1molCO2加热到1092℃并保持该温度,反应达平衡后,气相中CO气体所占的体积分数为 。
Fe(s)+CO2(g)的△H= 。已知1092℃该反应的平衡常数为0.357,则1200℃时该反应的平衡常数 0.357(填“>”“=”或“<”),在1L的密闭容器中,投入7.2gFeO和0.1molCO2加热到1092℃并保持该温度,反应达平衡后,气相中CO气体所占的体积分数为 。
(2)炼钢尾气净化后,可直接作熔融碳酸盐燃料电池(工作原理如右图)的燃料,则负极的电极反应为 。
(3)转炉炼钢,尾气中CO体积分数达58%—70%,某钢厂先用NaOH吸收CO生成甲酸钠,再吸收SO2生成保险粉(Na2S2O3),试写出甲酸钠和氢氧化钠混合溶液与SO2生成保险粉同时生成二氧化碳的化学方程式 。
(4)在550—650℃时,尾气烟尘中的Fe2O3与CO及H2气体可用于合成炼钢原料Fe3C,该反应的化学方程式为 。
(5)目前我国大多数企业是将CO转换为H2,然后用H2与N2反应合成氮,若收集到3360m2尾气,其中CO体积分数为60%,由于循环操作,假定各步转化率均为100%,理论上可获得NH3 1。
(1)pH=13的CH3COONa溶液加水稀释100倍后,pH________11(填“>”“=”或“<”)原因是______________________________________________(用离子方程式和必要的文字说明);pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH________NaOH溶液的pH(填“>”“=”或“<”);
(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(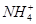 )由大到小的顺序为________;
)由大到小的顺序为________;
(3)等体积、等浓度的氢氧化钠与醋酸混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈________性,溶液中c(Na+)________c(CH3COO-)(填“>”“=”或“<”);
(4)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH)=c(Cl-),则混合后溶液呈________性,盐酸的体积________氨水的体积(填“>”“=”或“<”);
(5)NaHSO4在水中的电离方程式为NaHSO4=Na++H++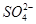 。该溶液中c(H+)_________________________c(OH-)+c(
。该溶液中c(H+)_________________________c(OH-)+c(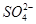 )(填“>”“=”或“<”)。
)(填“>”“=”或“<”)。
某温度(t ℃)时,水的离子积为KW=1.0×10-13,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是
____________________________________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是___________________________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |
(2)该反应进行到45 s时达到平衡,此时CO2的转化率为68.75%。下图1中的曲线表示该反应在前25 s内的反应进程中CO2浓度变化。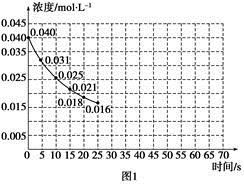
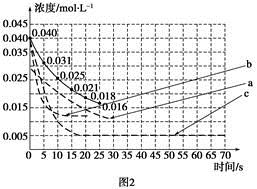
①若反应延续至70 s。请在图1中用实线画出25 s至70 s的反应进程曲线。
②某化学兴趣小组采用实验对比法分析改变实验条件对该反应进程的影响,每次只改变一个条件,并采集反应进程中CO2的浓度变化,在原有反应进程图像上绘制对应的曲线。实验数据如下表:
| 实验 编号 |
CO2起始 浓度/mol·L-1 |
反应温 度/℃ |
反应压 强/kPa |
是否加入 催化剂 |
| A |
0.030 |
150 |
101 |
否 |
| B |
0.040 |
150 |
101 |
否 |
| C |
0.040 |
250 |
101 |
是 |
但是该小组负责绘制图线的学生未将曲线(虚线)绘制完整(见图2),也忘记了注明每条曲线所对应改变的条件,请把每个实验编号与图2中对应曲线的字母进行连线。
实验编号 图2中字母
A a
B b
C c
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是(用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比(选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入Cmol。
(4)在同一容器中加nmolA和3n molB,则平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m间变化,那么,n与m的关系是_____________。(用字母n、m关系式表示)
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=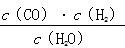 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。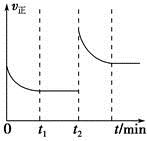
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。