在KMnO4中,Mn的化合价是
| A.+2 | B.+4 | C.+6 | D.+7 |
我国科学家发现金丝桃素对高致病性禽流感病毒杀灭效果良好,某种金丝桃素的结构式为: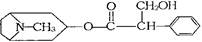 ,下列有关金丝桃素说法错误的是:( )
,下列有关金丝桃素说法错误的是:( )
| A.分子式为C17H23NO3 | B.可以发生加成、酯化等反应 |
| C.苯环上的一氯取代物有3种 | D.金丝桃素常温常压下为气态 |
与丙烯具有相同的碳、氢百分含量,但既不是同系物又不是同分异构体的是( )
| A.环丙烷 | B.环丁烷 | C.乙烯 | D.丙烷 |
在核磁共振氢谱中出现三组峰,其氢原子数之比为3:1:4的化合物是( )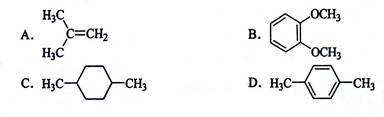
下列化合物,既能发生水解反应又能发生银镜反应的是( )
| A.甲酸丙酯 | B.乙酸乙酯 | C.2-羟基丁醛 | D.丁酸 |
下列叙述错误的是( )
| A.淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| B.乙烯和苯都能使溴水褪色,褪色的原因相同 |
| C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
| D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |