下列叙述正确的是
| A.CaCO3在水中溶解度很小,其水溶液导电性很弱,所以CaCO3是弱电解质 |
| B.A原子的最外层电子数比B原子多,则A单质的氧化性一定比B单质强 |
| C.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大 |
| D.任何宏观物质都是由微观粒子构成,而这些粒子之间又都存在着化学键 |
有关金属的腐蚀与防护的叙述正确的是
| A.金属的化学腐蚀比电化学发生普遍 |
| B.上图装置的原理是“牺牲阳极的阴极保护法” |
| C.金属腐蚀的本质是M-ne-→Mn+而被损耗 |
| D.用铝制铆钉来接铁板,铁板易被腐蚀 |
下列关于电化学的叙述正确的是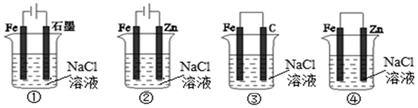
| A.图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红 |
| B.图②装置可以验证牺牲阳极的阴极保护法 |
| C.图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH- |
| D.分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀 |
下列有关金属腐蚀与防护的说法正确的是
| A.银器表面在空气中因电化腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
化学在工业生产和日常生活中有着重要的应用。下列说法不正确的是
| A.铁表面镀铜,铁作阳极 |
| B.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH- |
| D.在轮船外壳上镶入锌块,可减缓船体的腐蚀速率 |
下列叙述不正确的是
| A.铁表面镀锌,铁作阳极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| C.钢铁吸氧腐蚀的正极反应:O2 +2H2O+4e-=4OH— |
| D.工业上电解饱和食盐水的阴极反应:2Cl一 一2e一=C12↑ |