欲用浓硝酸法测定某铜银合金中铜的质量分数(测定反应后生成气体的量),但资料表明:①反应中除生成NO2气体外还有少量NO生成;②常温下NO2和N2O4混合存在,在低于0℃时,几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计了如图所示的实验装置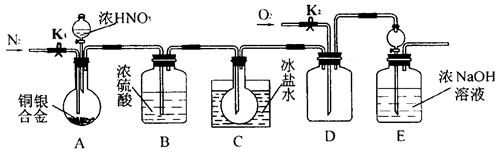
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___。
(2)装置中B瓶的作用是 。
(3)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是__ __。
(4)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 。
(5)C装置烧瓶中的物质是 ,用简单的实验证实你的判断: 。
(6)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是____________________________。
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯。在实验室也可以用如下图所示的装置制取乙酸乙酯,请回答下列问题。
(1)乙醇分子官能团名称是_______________。
(2)试管A中加入几块碎瓷片的目的是___________。
(3)试管A中发生反应的化学方程式为 ___________,反应类型是_______。
(4)反应开始前,试管B中盛放的溶液是____________。作用是___________。
(5)可用_________的方法把制得的乙酸乙酯分离出来。
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时检验氯气的氧化性。
(1)写出甲装置中电解饱和食盐水的离子方程式 。
(2)为完成上述实验,正确的连接顺序为A连________;B连________(填写导管口字母)。
(3)对硬质玻璃管里的氧化铜粉末加热前,需要进行的操作为________________。
(4)若检验氯气的氧化性,则乙装置的a瓶中溶液可以是______________,对应的现象为_______。
乙装置烧杯中发生反应的离子方程式是 。
(5)为测定Cu的相对原子质量,设计了如下甲、乙两个实验方案:精确测量硬质玻璃管的质量为a g,放入CuO后,精确测量硬质玻璃管和CuO的总质量为b g(假设CuO充分反应),实验完毕后:
甲方案:通过精确测量硬质玻璃管和Cu粉的总质量为c g,进而确定Cu的相对原子质量。
乙方案:通过精确测定生成水的质量d g,进而确定Cu的相对原子质量。
①请你分析并回答:________方案所测结果更准确。
你认为不合理的方案的不足之处是_____________________。
②若按合理方案测定的数据计算,Cu的相对原子质量为 。
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是 。
(2)烧杯间填满碎纸条的作用是 。
(3)环形玻璃搅拌棒能否用环形铁质搅拌棒代替 (填“能”或者“否”)其原因是 。
(4)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)。
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。为了验证这一事实,某同学拟用下图装置进行实验(实验时压强为10lkPa,温度为0℃)。
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是___________。
A.200 mL B.400 mLC.500mL
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g ,则圆底烧瓶中发生反应的化学方程式为:_____________。
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g。量气瓶中收集到VmL气体,则有:ag/65g·mol-1=bg/64g·mol-1+V mL/22400 mL·mol-1,依据的原理是________________。
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反 应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,n(H2)/n(SO2)=_______________(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,n(H2)/n(SO2)的数值将 (填偏大、偏小或无影响)
(5)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
① ;
② ;
③ 。
(Ⅰ)下列操作会导致实验结果偏高的是 。
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线
B.在配制一定物质的量浓度溶液时,用10 mL的量筒量取5.0 mL液体溶质时俯视读数
C.用天平称量20.5 g某物质,砝码和药品的位置放反,所得药品的质量
D.配制一定物质的量浓度的溶液时,定容时俯视读数,所得溶液的浓度
(Ⅱ)现有下列仪器或用品:
a铁架台(含铁圈、铁夹);
b锥形瓶;
c滴定管;
d烧杯(若干);
e玻璃棒;
f胶头滴管;
g托盘天平(含砝码);
h滤纸;
i量筒;
j漏斗;
k温度计
现有下列试剂:
A.NaOH固体B.碳酸钠溶液
C.氯化镁溶液 D.蒸馏水
试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是 。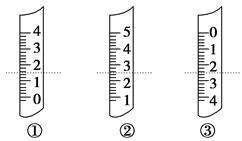
A.①是量筒,读数为1.5 mL
B.②是量筒,读数为2.50 mL
C.③是滴定管,读数为2.50 mL
D.①是温度计,读数是1.50 ℃
(2)配制100 mL 0.1 mol·L-1的氢氧化钠溶液时,还缺少的仪器有 。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用到的试剂是(选填序号),操作方法是 、 、洗涤。完成上述操作,上述仪器或用品用到的有(从上述仪器或用品中选择,填上相应序号)。