常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1) 从①组情况分析, HA是 酸(选填“强”、“弱”)。
(2) ②组情况表明,c 0.2 (填“>”、“=”或“<”)。
(3) 从③组实验结果分析,说明HA的电离程度______NaA的水解程度(填“>”、“=”或“<”),该混合溶液中离子浓度由大到小的顺序是 。
(4) ①组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
Ⅰ. 加入3mol SO2和2mol O2发生反应,达到平衡时放出的热量为 ____________
Ⅱ. 保持同一反应温度,在相同容器中,将起始物质的量改为 a mol SO2、 b mol O2 、c mol SO3 (g) ,欲使平衡时SO3的体积分数为2/9。
⑴达到平衡时,Ⅰ和Ⅱ放出的热量 ______(填序号)
A.—定相等 B.前者一定小 C. 前者大于或等于后者
(2) a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)________________
(1) 硝酸在该反应中表现的性质为_______________________
(2) 当a=0.3 时,则反应中转移的电子数为________mol,若此时收集到的气体在标准状况下的体积为8.96L,则该气体为__________________。
(3) 用NH3吸收硝酸生产中产生的尾气是一种较为先进的吸收方法,其产物对环境无污染,目前在工业生产以及汽车尾气处理中已被广泛应用。试写出用NH3恰好吸收(2)所产生气体的总化学方程式______________________________
(1)化合物G 的相对分子质量为140,G 中含硅元素,其质量分数为60%,另有元素Y。
G 可以由化合物E(含两种元素)与NH3反应而生成,同时产生HCl 气体。
请推断:G 和E的化学式分别为______________、______________。
(2)粉末状G 能够与氧气反应,所得产物中有一种是空气中的主要成分,另一种是工业上生产玻璃的主要原料。请写出化合物G 与氧气反应的化学方程式
(3)常压下在G 中添加氧化铝,经高温烧结可制成一种高强度、超硬废、耐磨损、抗腐蚀的陶瓷材料,它的商品名叫“赛伦”,化学通式可表示为Si6-XAlXOXY8-X。在接近1700℃时x的极限值约为4.0,在1400℃时 x为2.0,以保持整个化合物呈电中性。推测:赛伦中以下元素的化合价:Si_______Y______,塞伦的晶体类型__________
某天然油脂A的分子式为C57H106O6。1mol该油脂水解可得到1mol甘油、1mol不饱和脂肪酸B和2mol直链饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式:________。
(2)写出C的结构简式:________________;C的名称是__________。
(3)写出含5个碳原子的C的同系物的同分异构体的结构简式:__________。
Ⅱ.RCH==CHR′与碱性KMnO4溶液共热后酸化,发生双键断裂生成羧酸: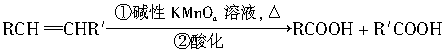 ,常利用该反应的产物反推含碳碳双键化合物的结构。在催化剂存在下,1mol不饱和脂肪酸B和1molH2反应后经处理得到D和E的混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热酸化后,得到如下四种产物:
,常利用该反应的产物反推含碳碳双键化合物的结构。在催化剂存在下,1mol不饱和脂肪酸B和1molH2反应后经处理得到D和E的混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热酸化后,得到如下四种产物:
HCOOC—(CH2)10—COOH CH3—(CH2)7—COOH
HCOOC—(CH2)7—COOH CH3—(CH2)4—COOH
(4)写出D和E的结构简式:__________________________________________________。
(5)写出B的结构简式:_____________________________________________________。
(6)写出天然油脂A的一种可能结构简式:_____________________________________。
1)用油脂水解制取高级脂肪酸和甘油,通常选择的条件是_________;若制取肥皂和甘油,则选择的条件是_________;液态油转化为固态脂通常在_________条件下,用油跟_________反应。
(2)将肥皂液分装在两支试管中,往第一支试管中加入稀H2SO4,现象为__________________,往第二支试管中加入CaCl2溶液,现象为___________________________,有关的离子方程式为___________________________,____________________________________。