某兴趣小组利用氨水能使酚酞试液变红的原理,设计如下实验以探究微粒的运动。请回答实验中的有关问题。
(1)实验I:在盛有少量蒸馏水的小烧杯中滴入2滴~3滴酚酞试液,再向其中滴加浓氨水。由实验I得出的结论有
(2)实验Ⅱ(如上图中甲所示):烧杯A中的现象是 ;产生这一现象的原因是 。
(3)为使实验结论准确可靠,该兴趣小组设计实验Ⅲ(如上图中乙所示)作为对比实验。你认为有无必要,理由是 。
小林同学在做探究质量守恒定律实验时,称取2.4g镁条在点燃的条件下与充足的空气反应,其反应的化学方程式为______________________________.实验完毕后,称得所得固体的质量小于4.0g.
【提出问题】固体质量为什么会小于4.0g呢?是否发生了其他反应呢?
【查阅资料】镁在空气中燃烧时,除了镁与氧气反应外,还可发生反应:
①2Mg+CO2点燃C+2MgO ② 3Mg+N2点燃Mg3N2
【猜想与假设】反应后固体质量小于4.0g是由于发生反应_______(填“①”或“②”)造成的,其理由是_____________________________.
【实验探究】根据初中化学所学知识用图所示装置除去空气中的氧气得到氮气(含少量稀有气体).可燃物应选择的物质是_________(填写物质的字母代号).
A.木炭B.红磷C.硫粉
选择的理由是________________________________________;
将点燃的镁条伸入所制得的氮气中,镁条在氮气中剧烈燃烧.
【实验结论】2.4g镁在空气中完全反应后所得固体质量小于4.0g,是由于生成的产物是___________的混合物所致.
某兴趣小组的同学为了探究化学反应前后反应物与生成物之间的质量关系设计了如下三个实验: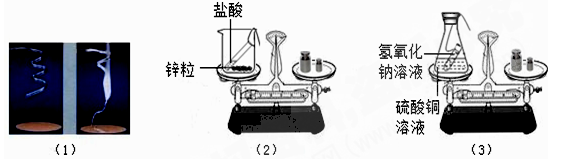
实验①:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量
实验②:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会再称量.
(化学方程式是:Zn+2HCl ZnCl2+H2↑)
ZnCl2+H2↑)
实验③:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触,过一会再称量.化学方程式是:CuSO4+2NaOH Cu(OH)2↓+Na2SO4
Cu(OH)2↓+Na2SO4
他们得到三次实验的数据见下表:
| 编号 |
实验① |
实验② |
实验③ |
| 反应前/g |
4.8 |
112.6 |
118.4 |
| 反应后/g |
8.0 |
112.4 |
118.4 |
(1)在实验①中反应后的质量比反应前明显增加了,请解释原因:
(2)由上表中数据分析可知实验①中参加反应的氧气质量为,实验②中生成氢气的质量为.
(3)在上述三个实验中都(填“遵循”或者“不遵循”)质量守恒定律,但只有实验能正确反映了反应物与生成物之间的总质量关系,因此,用实验来探究化学反应前后反应物与生成物之间的总质量关系时,当有时,必须在进行。
(4)请从分子、原子的角度解释反应前后质量相等的原因:
(5)在化学反应前后,肯定不会变化的是
①原子的数目②分子的数目 ③元素的种类④物质的质量总和
⑤物质的种类 ⑥物质的体积 ⑦物质的状态
过氧化钠(Na2O2)是一种淡黄色固体。在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如右图所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来。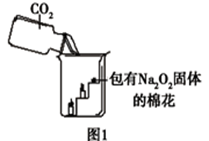
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳具有的性质。
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需满足、。
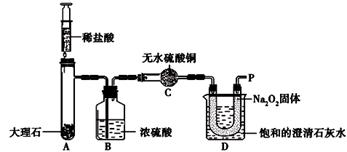
【提出问题】上述实验中是如何给棉花提供燃烧条件的?【查阅资料】1.在常温下Na2O2与CO2、H2O均能发生化学反应。2.无水硫酸铜为白色固体,吸水后变为蓝色。【实验设计】经过讨论,同学们设计用下图所示装置进行实验探究。
【实验步骤】①检查整套装置的气密性;②把相关的试剂放入对应的仪器内;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的木条,观察现象。注意:整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响。【实验现象】①带火星的木条复燃;②无水硫酸铜没有变蓝色;③饱和的澄清石灰水变浑浊。
【实验分析】D装置烧杯内澄清石灰水变浑浊的原因是。【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件。②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件。【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为_______同学的猜想是错误的,理由是。②写出Na2O2和CO2反应的化学方程式。
以下是初中化学的一些基本实验: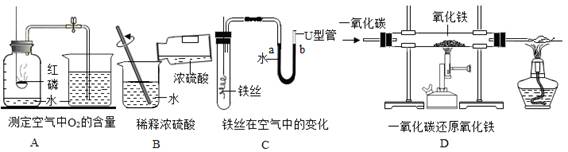
(1)A中可燃物应取过量的原因是,整个实验过程中观察到的现象是;
(2)B中玻璃棒的作用是
(3)一段时间后,C中的实验现象为___________________________________;
(4)D中玻璃管内发生反应的化学方程式为,酒精灯的作用是______________。
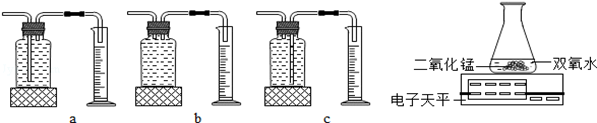
下面是实验室制取氧气的装置图,根据装置图回答下列问题: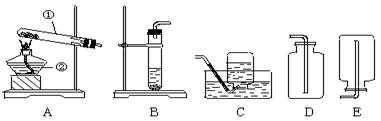
(1)写出装置图中标有①②序号的仪器名称:① ②
(2)实验室用高锰酸钾制取氧气的反应文字(或化学符号)表达式是 ;可选用的发生装置是 (写出装置代号)。
某兴趣小组同学对实验室制取氧气的条件进行如下探究实验.
为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比试验:
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将xg KClO3与1.0g CuO均匀混合加热
在相同温度下,比较两组实验产生O2的快慢.
Ⅱ.中x的值为
| 双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2的体积 |
|
| Ⅰ |
50.0g |
1% |
0.1g |
9mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31mL |
本实验中,测量O2的装置是 (填序号).
|