某兴趣小组的同学为了探究化学反应前后反应物与生成物之间的质量关系设计了如下三个实验: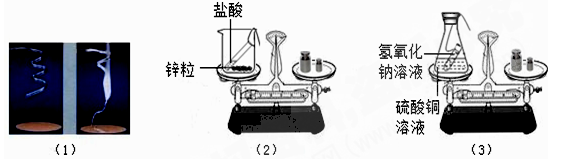
实验①:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量
实验②:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会再称量.
(化学方程式是:Zn+2HCl ZnCl2+H2↑)
ZnCl2+H2↑)
实验③:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后 设 法将两种溶液接触,过一会再称量.化学方程式是:CuSO4+2NaOH Cu(OH)2↓+Na2SO4
Cu(OH)2↓+Na2SO4
他们得到三次实验的数据见下表:
| 编号 |
实验① |
实验② |
实验③ |
| 反应前/g |
4.8 |
112.6 |
118.4 |
| 反应后/g |
8.0 |
112.4 |
118.4 |
(1)在实验①中反应后的质量比反应前明显增加了,请解释原因:
(2)由上表中数据分析可知实验①中参加反应的氧气质量为 ,实验②中生成氢气的质量为 .
(3)在上述三个实验中都 (填“遵循”或者“不遵循”)质量守恒定律,但只有实验 能正确反映了反应物与生成物之间的总质量关系,因此,用实验来探究化学反应前后反应物与生成物之间的总质量关系时,当有 时,必须在 进行。
(4)请从分子、原子的角度解释反应前后质量相等的原因:
(5)在化学反应前后,肯定不会变化的是
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和
⑤物质的种类 ⑥物质的体积 ⑦物质的状态
某学习小组利用右图装置完成如下实验,以验证所学物质的性质。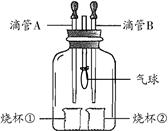
(1)若A中盛有浓盐酸,B中盛有紫色的石蕊试液,将A、B中液体分别滴入烧杯①、②中,一段时间后观察到的现象是。
(2)化学反应通常伴随能量的变化,可借助反应前后的温度变化来判断是否发生了反应。在不使用温度计的情况下,若A中盛有稀盐酸,烧杯①中盛有固体氢氧化钠,将A中的稀盐酸滴入烧杯①,观察到气球变瘪,则证明反应发生了。有的同学提出:该现象不足以证明NaOH与稀盐酸发生了化学反应。他的理由是:。(填一种即可)
(3)若将集气瓶中充满CO2,先将B中盛放的NaOH溶液滴入烧杯②中少量,会看到气球微微变鼓;再将A中的液体滴入烧杯①。请根据下列实验现象将下表中的试剂补充完整。
 现象 现象装置 |
① 气球变瘪又恢复原状 |
② 气球变瘪 |
③ 气球先变瘪后又变得更鼓 |
| 滴管A |
H2O |
||
| 烧杯① |
H2O |
固体Na2CO3 |
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛。小红同学设计实验对碳酸氢钠的性质进行了探究。请你参与她的探究活动。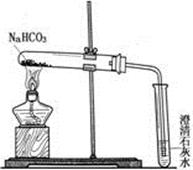
【生活应用】请说出碳酸氢钠在日常生活中的一种用途:___________________。
【探究实验1】碳酸氢钠溶液的酸碱性。
【实验方案】取少量该固体加入试管中,加适量水溶解,再滴入几滴酚酞试液,振荡。现象:溶液变成浅红色。结论:__________________________。
【探究实验2】能与酸反应。
【实验方案】取少量该固体加入试管中,滴加稀盐酸。现象:__________________________。
反应的化学方程式为:_______________________________________。
【探究实验3】碳酸氢钠的热稳定性。
【实验方案】设计实验装置如右图,并进行实验。
现象:试管口有水珠出现,澄清石灰水变浑浊。充分加热后,试管中留下白色固体。
结论:碳酸氢钠受热有二氧化碳、水和白色固体生成。
请你帮小红设计实验,证明试管中留下的白色固体是Na2CO3,而不是NaOH。(所选试剂不能用酸)注意:若答以下两空奖励4分,但化学总分不超过60分。
步骤:________________________________________________;
现象:________________________________________________。
写出碳酸氢钠受热发生反应的化学方程式:________________________________。
某化学兴趣小组在做Al和CuSO4溶液反应实验时,小明将Al丝插入到盛有CuSO4溶液的试管中,发现无明显现象,他非常困惑。小芳告述了他,这是因为 ,并告述了他处理的方法。他按照小芳告述的方法重新做了该实验,但他发现Al丝表面有红色物质析出的同时有气泡产生。这一现象激发了同学们的探究欲望,产生的气体是什么呢? 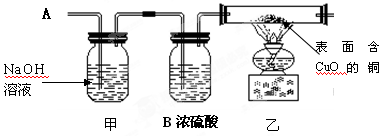
[提出猜想]该气体可能是SO2、O2、H2中的一种或几种。
同学们猜想该气体可能是SO2、O2、H2中的一种或几种。你认为他们提出该猜想的依据是 。
[查阅资料]SO2的性质与CO2相似。
[设计方案]同学们为验证自己的猜想,设计了如下方案:
(1)小明认为若是H2、 O2,实验方法略。
(2)小芳认为若是SO2 ,则只需将产生的气体通过盛有NaOH溶液的洗气瓶中,称量在通气前后洗气瓶的质量,即可验证。
(3)小组同学合作设计了上图所示装置,排除和验证猜想的气体。
[实验探究]小组同学首先称量装置甲的质量,再将收集的气体从A通入,过一会儿后点燃乙处的酒精灯;一段时间后,发现表面含有CuO的铜丝网变为光亮的红色;停止加热再停止通气体,再次称量装置甲的质量,发现质量无变化。
[实验结论]Al丝插入到CuSO4溶液时,产生的气体是 。
[实验反思](1)若不用称量装置甲的质量,如何判断SO2与NaOH溶液发生了反应呢?
小红又设计了下图所示的装置进行实验,她发现试管内液面上升了,于是他得出结论:SO2 与NaOH溶液发生了反应。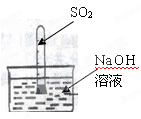
小华认为这一方案不严谨,不足以说明SO2 与NaOH溶液确实发生了反应。
他的理由是 。
要得到科学严谨的结论,小华思考后,仍用该装置,补充了一个实验来回答,这个补充实验是:。
小华采用的是 实验法。这一方法是我们学习化学的一个重要方法。
(2)通过上述实验,该小组同学得出CuSO4溶液中可能含有的物质是 。
化学实验课上,同学们利用下列实验探究碱的化学性质:
(1)甲实验中加入指示剂酚酞的目的是 ;
(2)丙实验中反应的化学方程式为;
(3)实验结束后,同学们将废液倒入同一只废液缸中,发现废液显红色,小刚脱口而出“废液中含有氢氧化钠”,小刚的说法正确吗?说明理由。
于是同学们对废液的成分展开讨论和探究:
【猜想与假设】通过分析上述实验,同学们猜想:废液中除酚酞外还一定含有,可能含有中的一种或几种(填一种组合)。
【实验验证】同学们取一定量的废液过滤后,向滤液中逐滴加入稀盐酸,根据反应现象绘制了如图所示的示意图。
【结论】分析图象得出可能存在的物质中,含有 ;
没有 。
请你参与某学习小组研究性学习的过程,并协助完成相关任务。
【研究课题】探究水壶内部水垢的主要成分
【查阅资料】通过查阅资料知道,天然水和水垢所含的物质及其溶解性如下表:
| 物质 |
Ca(HCO3)2 |
Mg(HCO3)2 |
Ca(OH)2 |
Mg(OH)2 |
CaCO3 |
MgCO3 |
| 溶解性 |
可溶 |
可溶 |
微溶 |
不溶 |
不溶 |
微溶 |
【提出猜想】水垢的主要成分一定含有Mg(OH)2和 ,可能含有Ca(OH)2和。【设计方案】(1)甲同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水充分搅拌,静置。取上层清液滴入Na2CO3溶液,如果没有白色沉淀,说明水垢中无(填化学式)。
(2)乙同学设计了下列实验装置,进一步确定水垢中含有碳酸盐的成分。其主要实验步骤如下: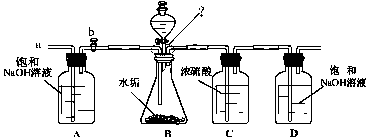
①按图组装仪器,将50g水垢试样放入锥形瓶中,逐滴加入足量稀盐酸。若D瓶增重22g,则水垢全部是CaCO3。②待锥形瓶中不再产生气泡时,打开活塞b,从导管a处缓缓鼓入一定量的空气;③称量D瓶内物质增加的质量;④重复②和③的操作,直至D瓶内物质质量不变。测量滴加稀盐酸体积与D瓶内物质增加质量的关系如下图曲线所示: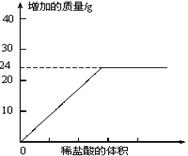
【评价】(1)A瓶中的NaOH溶液起到作用。若A瓶中无NaOH溶液,D瓶中的质量将(填“增大”、“不变”或“减小”)。
(2)一般情况下,两种不同金属形成的碳酸盐与足量盐酸反应时,若两金属的化合价相同、两种盐的质量相同,则相对分子质量小者放出的气体多。分析曲线图可知:水垢中一定含有
(化学式),理由是。
(3)以上实验(填“能够”或“不能”)检测出水垢中含有Mg(OH)2。