叠氮化钠(NaN 3)被广泛应用于汽车安全气囊,某化学小组同学对其进行下列研究。
【査阅资料】
①NaN 3受撞击会生成Na、N 2
②NaN 3遇盐酸、H 2SO 4溶液无气体生成
③碱石灰是CaO和NaOH的混合物
④NaN 3的制备方法是:将金属钠与液态氨反应制得NaNH 2,再将NaNH 2与N 2O反应可生成NaN 3、NaOH和NH 3
【问题探究】
(1)汽车受撞击后,30毫秒内引发NaN 3迅速分解,该反应的化学方程式为 ;
(2)工业级NaN 3中常含有少量的Na 2CO 3,其原因是 (用化学方程式表示);
(3)为测定某工业级NaN 3样品中Na 2CO 3的质量分数,小组同学设计了如图实验装罝:

①小明同学认为通过测定装置I中反应前后B的质量差,再通过相应计算,就可测定Na 2CO 3的质量分数,小组同学通过讨论认为不可行,其理由可能是 (答出一种即可)
②小明同学在大家讨论的基础上,又设计了装罝Ⅱ,请分析:装置Ⅱ中A的作用是 。若无装置C,对测定结果造成的影响是 (填"偏大"、"偏小"或"无影响")。装置E的作用是 。
③根据装置Ⅱ,小组同学设计的实验步骤有:
a.称量装置D
b.称量样品,检査装置气密性
c.打开弹簧夹,鼓入空气
d.关闭弹簧夹,打开分液漏斗的活塞和玻璃塞,注入足量的稀琉酸,关闭活塞和玻璃塞。
其正确的顺序为 (填字母序号,可重复)
④计算碳酸钠的质量分数时,至少需要测定 个数据。(填数字)
为确定木炭还原氧化铜后的固体成份,请你与兴趣小组的同学完成以下探究
【对固体猜想】
猜想I:全部是金属铜;猜想Ⅱ:除铜外,还含有氧化铜;
猜想Ⅲ:除铜外,还含有木炭;猜想Ⅳ:除铜外,还含有氧化铜、。
【进行实验】实验流程见下图: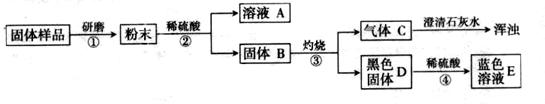 【问题与讨论】
【问题与讨论】
(1)步骤②包括溶解、两步操作,它们共同用到的玻璃仪器是烧杯、。
(2)C的化学式为,D的化学式为,由此推出固体B中含有(写化学式),步骤④发生反应的化学方程式为。
(3)结合(2)的结论推断:如果溶液A显蓝色,则溶液A的溶质的化学式为,说明样品中含有,则证明猜想成立;如果溶液A无色,则证明猜想成立。
实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
则CaO与水反应的反应方程式为。
(2)【实验】如图所示:
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想Ⅱ(填:成立、不成立)
b.操作④发生化学反应的方程式为;由操作⑤⑥的现象判断:滤液中含有(写化学式);由此判断猜想Ⅰ(填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为。
(4)【拓展】由上述实验说明,实验室中“碱石灰”应保存;操作③中玻棒的作用是。
现有以下仪器,请回答下列问题:
(1)仪器⑤的名称是;取用粉末状固体必须用到的仪器是(填序号)。
(2)如果用加热KMnO4的方法制取氧气,制气装置应选仪器(填序号)。
(3)如果用H2O2分解来制取氧气,制气装置最好选用仪器(填序号);其化学方程式为:;这种装置还可以用来制CO2,其收集气体的方法为法。
(4)比较(2)和(3)两种制取氧气的方法,最好选用方法(3)的原因是。(5)把上面分解KMnO4制取氧气的仪器装配好后,检验该装置气密性的操作方法为:。
现有以下实验仪器,请按要求填空:
(1)仪器⑤的名称是;配制一定质量分数的氯化钠溶液,需用到的仪器有(填序号),还缺少的仪器是(填名称);如果用石灰石与盐酸反应制取CO2,可选上述仪器中的(填序号)组合成制气装置。
(2)某同学利用仪器①与⑥组合成一个贮气装置。当装满水用排水法收集甲烷(甲烷难溶于水、比空气轻)时,气体应从仪器①的(填“a”或“b”)通入;集满甲烷后将其导出使用时,水应该从仪器①的(填“a”或“b”)导入。该装置还有其它用途,请你任举一例:。
(3)下列对实验现象或实验操作的叙述正确的是(填序号,选错一个扣1分,本小题不出现负分)。
①铁丝在空气中燃烧产生黄色火焰;
②镁条在空气中燃烧发出耀眼的白光;
③将CO还原Fe2O3的尾气直接排入空气;
④不慎将氢氧化钠溶液沾在皮肤上,要用较多的水冲洗,再涂上稀硼酸溶液;
⑤加热高锰酸钾制备氧气、并用排水法收集满氧气后,先移出导管,后撤酒精灯。
二氧化硫(SO2)的含量是空气质量监测的指标之一。请你参与兴趣小组对二氧化部分性质的实验探究。
(1)若雨水的pH小于5.6,表明空气受到污染。为了测定二氧化硫水溶液的pH,小明同学向一个集满二氧化硫气体的质地较软的塑料瓶中加入适量的水,立即旋紧瓶盖,振荡,使二氧化硫充分溶解(二氧化硫能与水反应形成亚硫酸),打开瓶塞,测定瓶中二氧化硫水溶液pH的实验操作是__________________。
(2)为了探究二氧化硫能否与氢氧化钠反应,小宁同学用右图所示装置进行实验,发现试管内液面上升。小宁同学由此得到结论:二氧化硫能与氢氧化钠反应。你认为小宁同学由上述实验得出的结论是否合理?(填 “是”或“否”),理由是______________________。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
分析上述数据变化,你可以得出的结论是;针对此结论,你猜测其中的原因为。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。