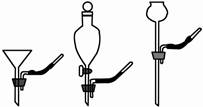
现有以下实验仪器,请按要求填空:
(1)仪器⑤的名称是 ;配制一定质量分数的氯化钠溶液,需用到的仪器有 (填序号),还缺少的仪器是 (填名称);如果用石灰石与盐酸反应制取CO2,可选上述仪器中的 (填序号)组合成制气装置。
(2)某同学利用仪器①与⑥组合成一个贮气装置。当装满水用排水法收集甲烷(甲烷难溶于水、比空气轻)时,气体应从仪器①的 (填“a”或“b”)通入;集满甲烷后将其导出使用时,水应该从仪器①的 (填“a”或“b”)导入。该装置还有其它用途,请你任举一例: 。
(3)下列对实验现象或实验操作的叙述正确的是 (填序号,选错一个扣1分,本小题不出现负分)。
①铁丝在空气中燃烧产生黄色火焰;
②镁条在空气中燃烧发出耀眼的白光;
③将CO还原Fe2O3的尾气直接排入空气;
④不慎将氢氧化钠溶液沾在皮肤上,要用较多的水冲洗,再涂上稀硼酸溶液;
⑤加热高锰酸钾制备氧气、并用排水法收集满氧气后,先移出导管,后撤酒精灯。
(11分) 在高效复习课堂中,同学们利用“硫酸、硝酸钡、氢氧化钠、碳酸钾” 四种物质的溶液对 “复分解反应发生的条件”进行再探究。
【知识回放】
通过判断上述四种溶液两两之间能否发生反应,我能写出其中符合下列条件的两个化学方程式:
⑴一个中和反应 ① ;
⑵一个有沉淀生成的反应 ② 。
【挖掘实质】
(1)图1是HCl和NaOH在水中解离出离子的示意图,我发现HCl在水中会解离出H+和Cl-,NaOH在水中会解离出Na+和OH-,以此类推硝酸钡在水中会解离出的离子是③(填离子符号)。
(2)图2是稀盐酸和氢氧化钠溶液发生化学反应的微观过程示意图,该化学反应的实质可以表示为H++ OH-=H2O,我也能用同样的方式表示上述四种溶液两两之间发生反应时有气体生成的反应的实质④。
(3)通过探究上述四种溶液两两之间是否发生反应的实质,我发现NaOH和H2SO4溶液能发生复分解反应,因为溶液中的H+和OH—不能大量共存;⑤溶液和⑥溶液也可以发生复分解反应(任写一组物质,下同),因为⑦;⑧和⑨溶液不能发生复分解反应,因为⑩(填离子符号,下同)也不能大量共存。
【知识升华】
通过对“复分解反应发生的条件”的再探究,我得出复分解反应发生条件的实质是11。
碳及许多含碳化合物不充分燃烧都要产生一氧化碳,一氧化碳是一种污染空气的有毒气体,它使人中毒的原因是,通常采用燃烧法处理尾气中的一氧化碳。某同学对一氧化碳与一定量的氧气反应后所得的气体成分进行了如下实验探究:
【提出猜想】反应后气体的组成可能是:①
;②只有
;③。
【实验探究】该同学为了验证自己的猜想,用下列装置进行实验:
①装置
中氢氧化钠溶液的作用是。
②装置
中出现的现象是,发生反应的化学方程式是,用带火星的木条伸入D中出现的现象是。
【实验结论】通过实验验证,猜想③成立。
①实验室制取二氧化碳结合下列实验装置图回答有关问题
Ⅰ.仪器 的名称是.
Ⅱ.用大理石和稀盐酸制取二氧化碳,反应的化学方程式是;二氧化碳的收集方法是.
Ⅲ.符合启普发生器原理的装置是(填编号).
②制取二氧化碳后剩余溶液的成分探究(假设二氧化碳已完全放出, 杂质不溶于水且不参加反应):
杂质不溶于水且不参加反应):
甲、乙同学分析认为剩余溶液中一定有氯化钙,可能有盐酸.为验证是否含有盐酸,他们采用了不同方法进行实验,得到了相同的结论.
查找资料:氯化钙溶液呈中性
| 实验操作 |
实验现象 |
结论 |
|
| 甲 |
取样于试管中,滴加试液 |
试液变红 |
有盐酸 |
| 乙 |
取样于试管中,逐滴滴加碳酸钠溶液至过量 |
丙同学取样于试管中,滴加硝酸银溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,由此得出和甲、乙一致的结论.甲、乙认为丙的实验设计不合理.理由是③从剩余溶液中得到尽可能多的氯化钙固体,同学们认为加入稍过量的(填化学式),经、蒸发等操作后即可完成.
(7分)小华同学用排水法收集了一大瓶沼气池中气体(图1中的A),为了弄清它的成分,进行了有关实验。请你与他一起完成以下探究活动:
【对气体猜想】猜想I:全部是CH4;猜想Ⅱ:全部是CO;
猜想Ⅲ:是CO和CO2的混合气体;猜想Ⅳ:是CH4和CO2的混合气体。
【实验和推断】将A中的气体依次通入B、C中,在D处点燃。
A B C D①②③
图1图2
(1)要将A中的气体通入后面的装置中,应选图2中的(填序号)“注水装置”。
(2)若B中石灰水变浑浊,则说明A中的气体中含有气体。
(3)装置C作用是。
(4)若D处倒扣的是涂有澄清石灰水的烧杯,出现浑浊,且B中无明显现象,则“猜想
”可能成立;若D处倒扣的是干冷的大烧杯,杯壁有水雾出现,有同学认为“猜想I、Ⅳ”可能成立,另有同学认为此现象不能证明收集到的气体中一定含有CH4,理由是;要排除这种干扰可采取的措施是。
(5)采取(4)中的排除干扰措施后:若D处分别倒扣干冷的烧杯和涂石灰水的烧杯,分别出现水雾和浑浊,且B中也出现浑浊,则证明“猜想”成立。
(8分)某兴趣小组发现一袋腌制松花蛋的泥料,配料表上的成分是氧化钙、纯碱和食盐。他们要探究在腌制松花蛋过程中都有哪些物质对鸭蛋起作用。于是取少量泥料在水中溶解,充分搅拌后过滤,取滤液探究其成分。
【猜想与假设】他们都认为滤液中一定有NaCl和NaOH。生成氢氧化钠的化学方程式为。对其他成分他们分别做出了如下猜想:
小亮猜想:还可能有Na2CO3
小强猜想:还可能有Ca(OH)2和Na2CO3
你认为谁的猜想是错误的,理由是。你还能做出的猜想是:还可能有。
【活动与探究】小亮取一定量的滤液于试管中,向其中滴加了几滴稀盐酸,振荡,没有气泡,于是他得出结论:没有Na2CO3。
请你选择CO2以外的物质,设计一个实验方案验证你的猜想。
| 实验步骤 |
现象及相应结论 |
【反思】小强认为小亮的结论不严密,理由是。