知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:
2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应的说法正确的是
| A.S2Cl2既作氧化剂又作还原剂 | B.H2O作还原剂 |
| C.每生成1mol SO2转移4mol电子 | D.氧化产物与还原产物物质的量比为3:1 |
室温下向10 mL 0.1 mol/L NaOH 溶液中加入0.1 mol/L 的一元酸HA 溶液pH 的变化曲线如图所示。下列说法正确的是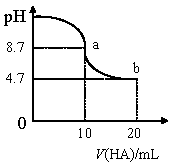
A.a 点所示溶液中c(A-)+c(HA)= 0.1mol/L
B.a、b 两点所示溶液中水的电离程度不同
C.pH="7" 时,c(Na+)=c(A-)+c(HA)
D.b 点所示溶液中c(HA) >c(A-)
在一定温度下,有以下反应:2A(g)+ B(g) 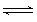 C(g)+D(g) △H<0 ,反应进行至第10 min 时,改变一个条件,当反应进行至第20 min 时,发现生成C的速率增大,C的百分含量也增大,则改变的条件可能是
C(g)+D(g) △H<0 ,反应进行至第10 min 时,改变一个条件,当反应进行至第20 min 时,发现生成C的速率增大,C的百分含量也增大,则改变的条件可能是
| A.加热 | B.使用催化剂 | C.加压 | D.分离出D |
某有机物的结构简式如图所示,有关该有机物的叙述正确的是
| A.分子中含有3 种官能团 |
| B.在一定条件下,能发生取代、氧化、酯化和加聚反应 |
| C.该物质分子中最多可以有10 个碳原子在同一平面上 |
| D.1 mol 该物质最多可与5 mol H2 发生加成反应 |
NA 代表阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,22.4 L 二氯甲烷的分子数约为NA个 |
| B.常温常压下,2.0 g 重水(D2O)中含NA个中子 |
| C.1 L 0.1mol·L-1的NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA |
| D.电解精炼铜时,若阴极得到的电子数为2 NA个,则阳极质量减少64 g |
常温下,下列各组离子一定能在指定溶液中大量共存的是
| A.pH="13" 的溶液:Na+、NH4+、SO42-、Cl- |
| B.甲基橙呈黄色的溶液:Na+、K+、ClO-、AlO2- |
| C.0.1 mol/L 的KNO3溶液:H+、Fe2+、Cl-、SO42- |
| D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Ba2+、Br-、I- |