某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数的测定。将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
(1)可以判断该分解反应已经达到化学平衡的是___________。
A.
B.密闭容器中总压强不变
C.密闭容器中混合气体的平均相对分子质量不变
D.密闭容器中气体密度不变
(2)根据表中数据,列式计算15.0℃时的分解平衡常数:__________________________。
(3)取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量______(填“增加”、“减小”或“不变”)。
(4)氨基甲酸铵分解反应的焓变△H____0,熵变△S___0(填>、<或=)。
成熟的苹果中含有淀粉、葡萄糖和无机盐等,某课外兴趣小组设计了一组实验证明某些成份的存在,请你参与并协助他们完成相关实验。
(1)用小试管取少量的苹果汁,加入 ,溶液变蓝,则苹果中含有淀粉。
(2)用小试管取少量的苹果汁,加入新制Cu(OH)2悬浊液,并加热,产生砖红色的沉淀,则苹果中含有 (写分子式)。
(3)葡萄糖在一定条件下可以得到化学式为C2H6O的化合物A。
A + CH3COOH→有香味的产物
① 含A的体积分数为75%的水溶液可以用做 。
②写出化合物A与CH3COOH反应的化学方程式为 ,该反应的类型为 。
(4)苹果中含有苹果酸,测得其相对分子质量为134。取0.02mol苹果酸,使其完全燃烧,将燃烧后的产物先后通过足量的无水CaCl2和碱石灰,两者分别增重1.08g 和 3.52g。则分子中C、H原子的个数比 。苹果酸的分子式是 。
直接甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源。
(1)101 kPa时,1 mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51 kJ/mol,则甲醇燃烧的热化学方程式为。
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H1="+49.0" kJ·mol-1
②CH3OH(g)+ O2(g)= CO2(g)+2H2(g) △H2
O2(g)= CO2(g)+2H2(g) △H2
已知H2(g)+ O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
O2(g)===H2O(g) △H ="-241.8" kJ·mol-1
则反应②的△H2= 。
(3)甲醇燃料电池的结构示意图如右。甲醇进入 极(填“正”或“负”),该极发生的电极反应为 。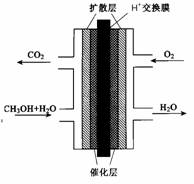
(4)已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:
N2 (g)+ 3H2 (g)= 2NH3(g)ΔH=" —92.4" KJ/mol,则N≡N键的键能是。
依据氧化还原反应:2Ag+ (aq)+Cu(s)=Cu2+ (aq)+2Ag(s)设计的原电池如图所示。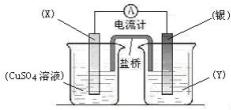
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极。外电路中每通过0.1 mol电子,银电极的质量理论上增加g。
(4)原电池工作时,盐桥(装有琼脂-KCl的U型管)里的Cl-移向电极。
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题: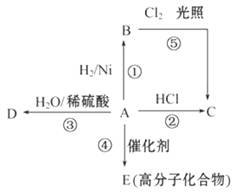
(1)写出A、B、C、D的结构简式:
A__________________________________________,
B__________________________________________,
C__________________________________________,
D__________________________________________。
(2)写出②、④、⑤三步反应的化学方程式,并注明反应类型:
②________________________________________,反应类型________________。
④________________________________________,反应类型________________。
⑤________________________________________,反应类型________________。
(12分)已知有以下物质相互转化
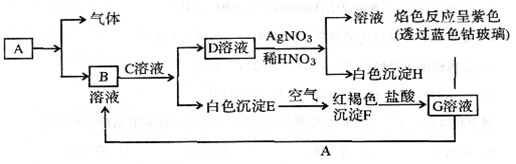
试回答:
(1)写出B的化学式__________;D的化学式__________。
(2)写出由E转变成F的化学方程式_______________________________。
(3)写出用KSCN鉴别G溶液的现象_________;向G溶液加入A的有关离子反应方程式_________________________________________。