已知A、B、C、D、E五种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的元素在元素周期表中的位置是 ;
(2)B和C的分子式分别是_______和_______,C分子的立体构型呈_____形,属于_______分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成,则D的结构式是________,该反应的化学方程式为__________________;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,则E是 (填名称)。E可以作为燃料电池的燃料,请写出以E为燃料,O2做氧化剂,KOH为电解质溶液组成的燃料电池的负极反应方程式 。
(1)可正确表示原子轨道的是 。
A.2s B.2d C.3p D.3f
(2)写出基态镓(Ga)原子的电子排布式 。
(3)下列物质变化,只与范德华力有关的是 。
A.干冰熔化
B.乙酸汽化
C.乙醇与丙酮混溶
D. 溶于水
溶于水
E.碘溶于四氯化碳
F.石英熔融
(4)下列物质中,只含有极性键的分子是 ,既含离子键又含共价键的化合物是 ;只存在σ键的分子是 ,同时存在σ键和π键的分子是 。
A N2 B CO2 C CH2Cl2D C2H4E.C2H6 F CaCl2 G NH4Cl
(5)用“>”“<”或“=”填空:
第一电离能的大小:Mg Al;熔点的高低:KCl MgO。
研究物质的微观结构,有助于人们理解物质变化的本质。请回答下列问题:
(1)C、Si、N的电负性由大到小的顺序是 。C60和金刚石都是碳的同素异形体,二者比较熔点高的是 ,原因是 。
(2)A、B均为短周期金属元素,依据下表数据,写出B的基态原子的电子排布式 。
| 电离能/(kJ·mol-1) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1 821 |
15 390 |
21 771 |
| B |
738 |
1 451 |
7 733 |
10 540 |
(3)过渡金属离子与水分子形成的配合物是否有颜色,与其d轨道电子排布有关。一般地,为d0或d10排布时,无颜色,为d1~d9排布时,有颜色。如[Co(H2O)6]2+显粉红色。据此判断,[Mn(H2O)6]2+ (填“无”或“有”)颜色。
(4)利用CO可以合成化工原料COCl2、配合物Fe(CO)5等。
①COCl2分子的结构式为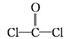 ,每个COCl2分子内含有 个σ键, 个π键。其中心原子采取 杂化轨道方式。
,每个COCl2分子内含有 个σ键, 个π键。其中心原子采取 杂化轨道方式。
②Fe(CO)5在一定条件下发生分解反应:Fe(CO)5(s)=Fe(s)+5CO(g),反应过程中,断裂的化学键只有配位键,则形成的化学键类型是 。
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为 。
(2)Na的原子结构示意图为 ,Na在氧气中完全燃烧所得产物的电子式为 。
(3)MgCl2在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点 (填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为 ;SiO2的晶体类型为 。
(1)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①上述两种解释中________(填“甲”或“乙”)正确。
②为了验证上述哪种解释正确,继续做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
| A.固体CH3COOK | B.固体CH3COONH4 |
| C.气体NH3 | D.固体NaHCO3 |
③若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。(已知25 ℃时CH3COONH4溶液呈中性)
(2)有甲、乙两同学做了如下实验:甲同学在制得的Mg(OH)2沉淀中加入浓的NH4Cl溶液,结果沉淀溶解;乙同学在制得的Mg(OH)2沉淀中加入浓CH3COONH4溶液,结果沉淀也完全溶解。对此甲、乙两同学用学过的有关知识各自解释了上述实验事实:
甲同学的解释为:因为NH4Cl溶液中,NH4++H2O NH3·H2O+H+,且Mg(OH)2(s)
NH3·H2O+H+,且Mg(OH)2(s) Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
Mg2+(aq)+2OH-(aq);又H++OH-===H2O,所以Mg(OH)2溶解平衡向右移动,促进Mg(OH)2的溶解。
乙同学的解释为:因为CH3COONH4===CH3COO-+NH4+,且Mg(OH)2(s) Mg2+(aq)+2OH-(aq),NH4++OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
Mg2+(aq)+2OH-(aq),NH4++OH-===NH3·H2O,所以Mg(OH)2溶液平衡向右移动,促进Mg(OH)2的溶解。
你认为哪一位同学的解释是正确的?________,为什么?____________________。
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)写出镁在CO2中燃烧的化学方程式为________________________。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是__________。
②由MgO可制成“镁-次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为___________________。


图1图2图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K=______________。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH_______(填“>” “<”或“=”)0。
③在两种不同温度下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ ________KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) (a、b、c均不等于0) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________。