根据下面图示,回答下列问题。(已知A是常见金属单质)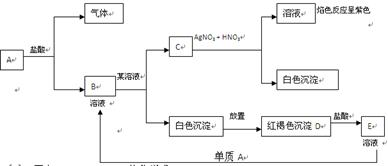
(1) 写出A、B、C、D、E的化学式
A: B:
C: D:
E:
(2)按要求书写化学方程式
①E B
B
②放置生成D
③E具有净水作用,反应原理是________________________________
④工业上炼制A的最主要反应方程式 _________________________________
(13分)(1)下列物质能导电的是________,属于电解质的是________(填序号)。
①NaCl晶体 ②液态SO2 ③液态醋酸 ④汞
⑤BaSO4固体 ⑥纯蔗糖(C12H22O11) ⑦氨水 ⑧熔化的KNO3
(2)按要求写出下列方程式:
KHSO4熔融状态电离方程式:______________。
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4===2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目。_____________。
②As2O3在上述反应中显示出来的性质是_____________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
③该反应的氧化产物是________。
④若生成0.2 mol AsH3,则转移的电子数为_______________。
(4)当溶液中X2O72-与SO32-数目之比为1∶3时正好完全发生氧化还原反应,X在还原产物中的化合价为________。
(8分)有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸胶体、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:
(1)电泳:甲液体的阳极(即接电源正极的一极)周围颜色变浅,阴极(即接电源负极的一极)周围颜色变深;
(2)将一束光通过乙液体,无丁达尔现象;
(3)将乙慢慢加入到丙液体中,先出现凝聚,后液体变澄清。
则甲为________,乙为________,丙为________,丁为________。
(10分)已知某“84消毒液”瓶体部分标签如下所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
84消毒液
【有效成分】 NaClO
【规格】 1000 mL
【质量分数】 25%
【密度】 1.19 g·cm-3
(1)该“84消毒液”的物质的量浓度约为________mol·L-1(小数点后保留一位)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是______(填序号)。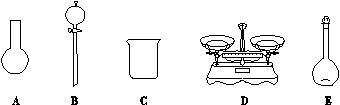
| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0 g |
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中, H+的物质的量浓度为________mol·L-1。
②需用浓硫酸的体积为________mL。
如图所示3套实验装置,分别回答下列问题:


(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入KSCN溶液呈无色,再滴入氯水即可观察到铁钉附近的溶液变红色,表明铁被_______;向插入碳棒的玻璃筒内滴入酚酞试液,可观察到碳棒附近的溶液变红,该电极反应为_______________。
(2)装置2中的石墨是_________极(填“正”或“负”),该装置发生的总反应的离子方程式为__________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞试液,观察到石墨电极附近首先变红。
①电源的M端为_________极,甲烧杯中铁电极的电极反应为________________;
②乙烧杯中电解反应的离子方程式为______________;
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.64 g,则甲烧杯中产生的气体在标准状况下为________ mL。
直接甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
(1)101KPa时,1mol气态CH3OH完全燃烧生成CO2气体和液态水时,放出726.51kJ的热量,则甲醇燃烧的热化学方程式是 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O (g)═CO2(g)+3H2(g);△H1═+49.0KJ•mol﹣1
②CH3OH(g)+ O2(g)═CO2(g)+2H2(g);△H2═?
O2(g)═CO2(g)+2H2(g);△H2═?
已知H2(g)+ O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
O2(g)═H2O (g)△H═﹣241.8KJ•mol﹣1,则反应②的△H2= .
(3)一种甲醇燃料电池是采用铂或碳化钨作电极,稀硫酸作电解液,一极直接加入纯化后的甲醇,同时向另一个电极通人空气.则甲醇进入 极,正极发生的电极反应方程式为 .