下表中对实验操作、现象的描述及对应的解释、结论正确的是
| 选项 |
实验操作、现象 |
解释、结论 |
| A. |
铜片放入浓硫酸中,无明显变化 |
铜在冷的浓硫酸中会发生钝化 |
| B. |
往某氯化物溶液中滴加氨水,产生白色沉淀 |
该氯化物是AlCl3 |
| C. |
将10ml某pH=3的HA溶液加水稀释到100ml,所得溶液pH=3.8 |
HA是弱酸 |
| D. |
往MgCl2溶液中滴加NaOH溶液,调至pH=9时,开始出现沉淀[已知Mg(OH)2的Ksp=5.6×10-12] |
原溶液中 c(Mg2+)=5.6×10-2mol·L-1 |
在N2+3H2 2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是
2NH3的反应中,在5s中N2由6mol/L减至2mol/L。则NH3的平均反应速率是
| A.2.4 mol/(L·s) | B.1.6mol/(L·s) |
| C.0.8 mol/(L·s) | D.0.08 mol/(L·s) |
将ag块状碳酸钙跟足量的盐酸反应,反应物损失的质量随时间的变化曲线如图中的实线所示,在相同条件下,将bg(a>b)粉末状碳酸钙与同浓度的盐酸反应,则相应的曲线如图中的虚线所示。其中正确的是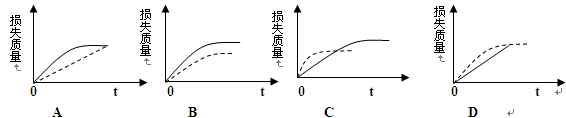
把a、b、c、d四种金属片浸泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极,则这四种金属活动性顺序由到小为
| A.a>b>c>d | B.a>c>d>b |
| C.c>a>b>d | D.b>d>c>a |
已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2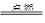 CO2+2H2O CO2+2H2O |
B.CaCO3 CaO+CO2↑ CaO+CO2↑ |
C.2H2O  2H2↑ + O2↑ 2H2↑ + O2↑ |
D.Pb+PbO2+2H2SO4  2PbSO4+2H2O 2PbSO4+2H2O |
对于100mL 1mol/L盐酸与铁片的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 3mol/L盐酸;③多用300mL 1mol/L盐酸;④用等量铁粉代替铁片;⑤改用98%的硫酸
| A.①③④ | B.①②④ | C.①②③④ | D.①②③⑤ |