现有X、Y、Z、W四种短周期元素,原子半径:r(X)>r(Y) >r(Z) >r(W)。X、Y、Z处于同一周期,Z、W处于同一主族;X、Y、Z的原子序数之和为40。下列说法中正确的是
| A.Y的最髙价氧化物对应的水化物一定是强碱 |
| B.Z 一定位于第三周期VIIA族 |
| C.若X、Y、W可形成化合物XYW2,则该化合物的水溶液呈碱性 |
| D.X与足量的W加热反应会生成化合物X2W |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)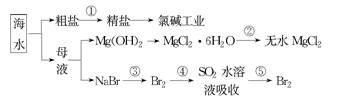
下列有关说法正确的是( )
| A.大量的氰、磷废水排入海洋,易引发赤潮 |
| B.工段②中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.在工段③④⑤中溴元素均被氧化 |
| D.工段①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为: |
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
化学在生产和日常生活中有着重要的应用。下列说法不正确的是( )
| A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.高温水解Al2O3可制得金属铝 |
| C.MgO的熔点很高,可用于制作耐高温材料 |
| D.根据冷的浓硫酸可以用铝质容器储存的事实,说明常温下铝不会与浓硫酸发生反应 |
自来水加工处理流程如下,下列有关说法不正确的是( )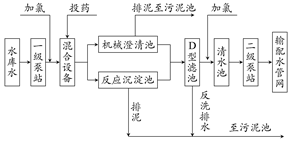
| A.若用FeSO4作混凝剂,最终铁将以Fe(OH)2形式进入反应沉淀池 |
| B.投药时常加入适量的石灰,是为了除去水中Mg2+、HCO3-等 |
| C.自来水生产中,前面加氯起消毒杀菌作用,后面加氯是保持水中有效氯的含量,防止自来水二次污染 |
| D.用ClO2消毒自来水,消毒效率是等质量氯气的2.63倍 |
广东正在建设海洋强省。下列说法不正确的是( )
| A.从海带中提取碘单质的过程涉及氧化还原反应 |
| B.往淡水中加入NaCl等配成的人造海水,可用于海产品的长途运输 |
| C.赤潮主要是由工农业生产和生活废水引起沿海水域的富营养化而造成的 |
| D.海洋经济专属区的资源开发可获得Fe、Co、K、Au、Mg、B等金属 |
若实行海水淡化供应饮用水,下列方法在原理上完全不可行的是( )
| A.用明矾使海水中的盐分沉淀而淡化 |
| B.利用太阳能使海水蒸馏而淡化 |
| C.将海水缓慢凝固以获取淡化的饮用水 |
| D.将海水通过离子交换树脂,以除去所含盐分的离子 |