.二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,是一种黄绿色的气体,易溶于水。
Ⅰ.(1)ClO2可由KClO3在H2SO4存在的条件下与Na2SO3反应制得。则该反应的氧化产物与还原产物的物质的量之比是 。
Ⅱ.实验室也可用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下: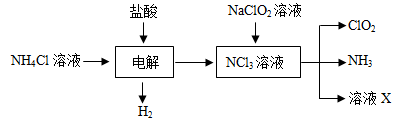
(2)写出电解时发生反应的化学方程式: ;
(3)除去ClO2中的NH3可选用的试剂是 ;(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 |
(4)测定ClO2(如图)的过程如下:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用cmol/L硫代硫酸钠标准溶液滴定 (I2+2S2O32-=2I-+S4O62-),共用去VmL硫代硫酸钠溶液。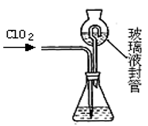
①装置中玻璃液封管的作用是 ;
②请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式 ;
③滴定终点的现象是: 。
④测得通入ClO2的质量m(ClO2)= 。(用含c、V的代数式表示)
(5)用ClO2处理过的饮用水(PH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子ClO2—。2001年我国卫生部规定,饮用水的ClO2—含量应不超过0.2mg/L。若饮用水中
ClO2—的含量超标,可向其中加入适量的某还原剂,该反应的氧化产物是 (填化学式)。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为: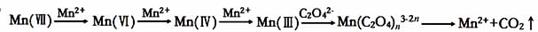
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是。
【设计、完成实验】
(1)称取g草酸晶体(H2C2O4·2H2O),配置500mL 0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和。
②下列操作会使所配溶液浓度偏低的是(填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
| 实验 编号 |
烧杯中所加试剂及用量(mL) |
控制条件 |
溶液褪色时间(s) |
|||
| 0.10mol/L H2C2O4溶液 |
等浓度 KMnO4溶液 |
H2O |
0.50mol/L 稀硫酸 |
|||
| 1 |
30 |
20 |
30 |
20 |
18 |
|
| 2 |
30 |
20 |
30 |
20 |
水浴控制温度65℃ |
15 |
| 3 |
30 |
20 |
30 |
20 |
加入少量MnSO4固体 |
3.6 |
| 4 |
30 |
20 |
x |
20 |
加入5mL 0.10mol/L K2SO4溶液 |
18 |
则x =,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为。上述实验中KMnO4溶液的物质的量浓度为。
(15分)亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O
②气体液化的温度:NO2为21 ℃,NO为-152 ℃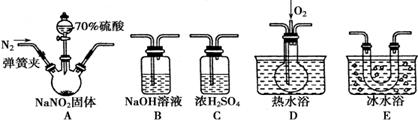
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是_________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是______________。
②装置E的作用是______________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为_____________。如果没有装置C,对实验结论造成的影响是_______________________________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是_________________。
某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹)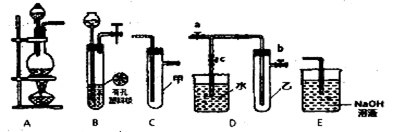
(1)在进行气体制备时,应先检验装置的气密性。将A装置末端导管密封后,在A装置的分液斗内装一定量的蒸馏水,然后,则证明A装置的气密性良好。
(2)用锌粒和稀硫酸制各H2时应选用装置____作为发生装置(填所选装置的序号字母),实验时可先在稀硫酸溶液中加入少型硫酸铜晶体会使反应速率加快,原因是。
(3)某同学利用上述装置设计实验证明Cl2氧化性强于Br2
①选用的装置连接顺序为:()→()→()(填所选装置的序号字母):
②从以下试剂中选用该实验所需的试剂为(填试剂的序号字母):
a.浓硫酸
b.浓盐酸
c.二氧化锰
d.氯化钠
e.溴化钠溶液
③实验过程中能说明Cl2氧化性强于Br2的实验现象是;
(4)另-同学将B、D、E装置连接后,茬套囊璧中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置发生反应的离子方程式为____;
②反应一段时间后D装置中的具支试管乙中收集满NO2气体,若进行NO2气体与水反应的实验,应(填“对a、b、c三个止水夹进行的操作”),然后再适当加热乙。
③E装置中的NaOH溶液可吸收尾气NO2,反应生成NaNO3、NaNO2和H2O,反应中生成的NaNO3和NaNO2的物质的量之比为。
软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O的流程如下:
已知:①部分金属阳离子完全沉淀时的pH如下表
②温度高于27℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
(1)“浸出”过程中MnO2转化为Mn2+的离子方程式为;
(2)第1步除杂中加入H2O2的目的是。
(3)第1步除杂中形成滤渣l的主要成分为(填化学式),调pH至5-6所加的试剂,
可选择(填以下试剂的序号字母);
a.CaO b.MgO c.Al2O3 d.氨水
(4)第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子反应方程式,该反应的平衡常数数值为。
(已知:MnF2的Ksp=5.3×10-3;CaF2的Ksp=1.5×10-10;MgF2的Ksp=7.4×10-11):
(5)采用“趁热过滤”操作的原因是。
(6)取少量MnSO4·H2O溶于水,配成溶液,测其pH发现该溶液显酸性,原因是(用离子方程式表示),该溶液中所有离子的浓度由大到小的顺序为。
用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)制取高纯铁红,实验室常用萃取剂X(甲基异丁基甲酮)萃取法制取高纯铁红的主要实验步骤如下: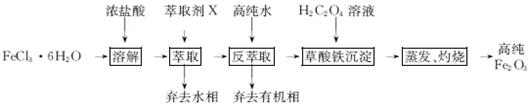
已知:HCl(浓)+FeCl3 HFeCl4
HFeCl4
试回答下列问题:
(1)用萃取剂X萃取,该步骤中:
①Ca、Mn、Cu等杂质离子几乎都在(填“水”或“有机”)相。
②若实验时共用萃取剂X 120 mL,萃取率最高的方法是(填字母)。
a.一次性萃取,120 mL
b.分2次萃取,每次60 mL
c.分3次萃取,每次40 mL
(2)用高纯水反萃取,萃取后水相中铁的存在形式是(写化学式);反萃取能发生的原因是。
(3)所得草酸铁沉淀需用冰水洗涤,其目的是。
(4)测定产品中铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标准K2Cr2O7溶液滴定,已知铬的还原产物为Cr3+,写出该滴定反应的离子方程式,并用单线桥标出电子转移的方向和数目。