食盐和工业用盐具有广泛的用途。已知,工业盐含NaNO2,外观酷似食盐并有咸味。NaNO2有氧化性和还原性,遇酸分解放出NO2。
(1)下列试剂可鉴别工业盐和食盐的是
a. H2O b.酸性高锰酸钾溶液 c.盐酸
(2)NaNO2与氢碘酸反应(含氮产物为NO)的离子方程式为 .
(3)某工厂废液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就 能使NaNO2中的氮转化为对空气无污染的气体,该物质是
能使NaNO2中的氮转化为对空气无污染的气体,该物质是
a.NaCl b.NH4Cl c.浓H2SO4
(4)氯碱工业通过电解饱和食盐水来获得相应的产物。请写出电解食盐水的离子方程式 。
物质在水溶液中有不同的行为。按要求回答下列问题:
(1)Na2SO3溶液显碱性,其原因是______________________________(用离子方程式表示),该溶液中各离子浓度由大到小的顺序为______________________。
(2)室温下向10mL氨水溶液中加水稀释后,下列量增大的有__________(填编号,下同),减小的有___________,不变的有____________。
a.溶液中离子浓度b.氨水的电离程度
c.水的离子积常数 d.c(H+)/ c(NH3·H2O)
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。NaClO2变质可分解为NaClO3和NaCl。取等质量已变质和未变质的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量(填“相同”或“不相同”),其原因是。
一种常用化学胶水的主要成分是聚乙烯醇,工业上以烃A为主要原料合成,其合成路线如下(某些反应条件略去):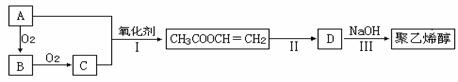
已知:B的分子式为C2H4O,B的核磁共振氢谱中有两个峰,峰面积之比为3∶1;
不饱和碳原子与羟基直接相连不稳定。
请回答下列问题:
(1)A的结构简式为;
(2)聚乙烯醇中含有的官能团的名称为;
(3)反应Ⅲ的反应类型是;
(4)与CH3COOCH=CH2含有的官能团相同的同分异构体还有种;
(5)写出反应II的化学方程式。
一定条件下, Ni2+与丁二酮肟生成鲜红色沉淀A。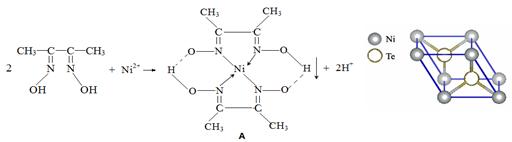
(1)基态Ni原子的价层电子排布式为。
(2)丁二酮肟组成元素中C、N、O的第一电离能由小到大的顺序为。
丁二酮肟分子中C原子轨道的杂化类型是。
(3)元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为。
(4)Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为-19.3℃。Ni(CO)4的晶体类型是。请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式。
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。我国蕴藏着丰富的钇矿石( Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| 开始沉淀时的pH |
完全沉淀时的pH |
|
| Fe3+ |
2.7 |
3.7 |
| Y3+ |
6.0 |
8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸和下列选项中的试剂(填字母代号),
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
再通过操作方可实现(填实验操作名称)。
②写出Na2BeO2与足量盐酸发生反应的离子方程式:;
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在
的范围内;继续加氨水调节pH =b发生反应的离子方程式为,溶液中Fe3+完全沉淀的判定标准是。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热(填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为[25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)]。
(6)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。
正确的连接顺序是a→b→(按接口连接)。B中盛放的试剂是,确定存在二氧化碳气体的实验现象是。