氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为 、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为 。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH |
< 8.0 |
8.0 ~ 9.6 |
> 9.6 |
| 颜色 |
黄色 |
绿色 |
蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为 [25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)]。
(6)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C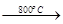 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要 。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。
正确的连接顺序是a→b→ (按接口连接)。B中盛放的试剂是 ,确定存在二氧化碳气体的实验现象是 。
某共价化合物含 C 、 H 、 N三元素 , 分子内有 4 个 N 原子 , 且 4 个 N 原子排列成内空的四面体 ( 如白磷分子结构 ), 每两个 N 原子间都有一个 C 原子 , 分子内无C-C单键和C=C双键。
(1) 试确定该化合物的分子式_____________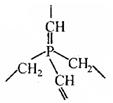
(2) 假若某大分子 , 分子内只含 C 、 H 、 P 二种元素 , 其最小的重复的结构单元如上图当该化合物分子中含n个磷原子时,则该化合物的组成可表示为____________________。
己知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复: NH4+、Ba2+、 Na+、H+、SO42-、NO3-、OH-、CO32-,将这4种溶液分别标记为A、B、C、D进行如下实验:①在A或D中滴入C,均有沉淀生成;② D和B反应生成的气体能被A吸收;③ A和D反应生成的气体能被B吸收。试回答下列问题 :
(1) D的化学式是, 判断理由
(2) 写出其余几种物质的化学式 : ABC
(3) 写出实验②中有关反应的离子方程式
在一定条件下,RO3n-和I-可以发生反应,离子方程式如下:
RO3n-+6I-+6H+===R-+3I2+3H2O
(1)RO3n-中R元素的化合价为(2)R元素的原子核外最外层电子数为个。
X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是。
(2)ZW2的电子式是,它在常温下呈液态,形成晶体时,属于晶体。
(3)工业生产单质Y的原理是(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_______比。
下图中每一字母表示一种反应物或生成物(反应时所需要的水或生成的水均已略去)。已知D是一种盐,焰色反应呈紫色,E在常温下是黄绿色气体,F是一种能使品红溶液褪色的无色气体。
请回答下列问题: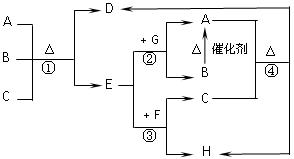
(1)写出D的化学式。
(2)写出反应①的离子方程式
③的离子方程式
(3)在反应①中每生成1molE,转移电子数为mol。