已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
C(g) △H<0。达到平衡时,C的体积分数为40%。试回答有关问题:
(1)升温时,C的反应速率_______(填“加快”、“减慢”或“不变”)。
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡__ _____。
_____。
| A.一定向正反应方向移动 | B.一定向逆反应方向移动 |
| C.一定不移动 | D.不一定移动 |
(3)若使温度、压强都保持和题干中的一样不变,在密闭容器中充入2mol A和2 mol B,则反应达到平衡时:A的转化率为_______(精确到0.01%),容器的容积为_______L。
(9分)一种常用融雪剂的主要成分的化学式为XY2,X原子的结构示意图为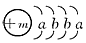 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m=________,该融雪剂的化学式为________。
(2)W元素的名称为________,H2Z的结构式是________。
(3)下列说法正确的是________。
| A.XY2和WZ2都为离子化合物 | B.XY2中仅含离子键,WZ2中仅含共价键 |
| C.H2Z比HY的稳定性强 | D.X的阳离子比Y的阴离子半径大 |
(4)Y元素的单质与H2Z水溶液反应会将Z单质置换出来,请写出该反应的化学方程式,氧化性比较:ZY2(填“>”或“<”)。
(9分)按要求填空,回答下列问题。
(1)第三周期中,原子半径最小的元素是(稀有气体元素除外)_____________;ⅦA族中,非金属性最强的元素是_____________(填写元素符号)。
(2)铷、氯、锗三种元素中,适合做半导体材料的是(填元素名称)。
(3)X元素的原子核外有2个电子层,其中L层有5个电子,该元素在周期表中的位置为,其气态氢化物的化学式,最高价氧化物的化学式为,该元素最高价氧化物对应水化物与其氢化物反应产物的化学式为。
(4)氮化铝(A1N)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平。
Al2O3 +N2 +C — AlN + CO
[化学—选修3:物质结构与性质]有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小。围绕上述元素,回答下列问题:
(1)Q的电子排布图为,YQ3中心原子的杂化类型为,除X外,其余元素的第一电离能由小到大顺序为(元素符号回答)。
(2)X2P和ZP2固态时均为分子晶体,但熔点X2P比ZP2高得多,原因是。
(3)固体A是离子晶体,结构类似于CsCl,组成中含W的质量分数为73.7%,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,该物质适当加热就分解成两种单质气体。该物质的电子式,其与水反应的化学方程式为。
(4)Z单质有三类异形体,其中一种骨架型原子晶体的立方晶胞如图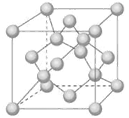
计算晶体中Z原子的空间利用率为( )。
)。
[化学—选修2:化学与技术]南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水。
(1)硬水是指含有较多______________的水,硬水加热后产生沉淀的离子方程式为:
___________________________________________________(写出生成一种沉淀物的即可)。
(2)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),已知水的硬度在8°以下的软水,在8°以上的称为硬水。已知岛上山泉水中c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×l0-4mol/L,那么此水__________________________(填“是”或“否”)属于硬水。
(3)离子交换法是软化水的常用方法。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式__________________________
(4)解放军战士通常向水中加入明矾净水,请用离子方程式解释其净水原理:____________________________________________________。
(5)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO 等离子,电极为惰性电极。请分析下列问题:
等离子,电极为惰性电极。请分析下列问题:
①离子交换膜是指__________________________(填A或B)。
②写出通电后阳极区的电极反应式__________________________________________________,阴极区的现是:____________________________________________________
(共14分)(1)美国麻省理工学院(MIT)近年来设计出镁锑液态金属电池,其工作原理如图所示,负极金属失去电子,并通过外电路做功,而负极金属离子化后通过熔盐迁移到正极并与正极金属合金化;充电则执行相反的过程。
写出电池放电时的正极反应式为。
(2)我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物。某冶金课题组进行三氯化锑水溶液的电解研究,然后利用电解过程中阳极生成的五氯化锑作为浸出剂,对辉锑矿进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题。流程如图:
①写出锑元素在周期表中的位置。
②“工业三废”指的是。
③电解过程中阳极主要是Sb3+被氧化成Sb5+。请写出阴极的电极反应式。
④根据流程图写出“浸出”步骤发生反应的化学方程式 。
⑤已知浸出液中除Sb3+外,还有Cu2+、Pb2+等重金属离子,其中c(Cu2+)=1.6×10-3mol·L-1,向浸出液中加入硫化钠至溶液中的Cu2+刚好完全沉淀,则c(S2-)=。(已知Ksp(CuS)=8×10-45Ksp(PbS)=3.4×10-28)
⑥还原除砷的原理是:在大于4mol·L-1的HCl溶液中,以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:
AsCl3 + Na3PO2 + HCl + H2O = As ↓+ H3PO3 + NaCl