下列反应的离子方程式正确的是 ( )
A.硝酸银溶液中加入铜粉: |
B.AlCl3溶液中滴加氨水: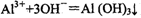 |
C.稀H2SO4与Ba(OH)2溶液反应: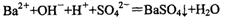 |
D.在氯化亚铁溶液中加入稀硝酸: |
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热,其质量变为w2g,则该样品的纯度(质量分数):
A. |
B. |
C. |
D. |
一定量的物质的量相等的镁和铝的混合物,分别放入足量的下列溶液中,充分反应后,放出的氢气最多的是
| A.3mol/LHCl | B.4mol/LHNO3 | C.8mol/LNaOH | D.浓H2SO4 |
下列有关NaHCO3和Na2CO3性质的比较正确的是
| A.热稳定性:Na2CO3<NaHCO3 |
| B.常温时在水中的溶解度:Na2CO3<NaHCO3 |
| C.等质量的NaHCO3和Na2CO3与足量盐酸反应产生CO2的量:Na2CO3<NaHCO3 |
| D.等物质的量的NaHCO3和Na2CO3与足量的盐酸反应,产生的CO2的量:Na2CO3<NaHCO3 |
某无色透明溶液能与铝作用放出氢气,且溶液中的离子能大量共存的是
| A.K+、NO3-、OH-、Cl- | B.Cu2+、SO42-、H+、Na+ |
| C.H+、Ba2+、Mg2+、NO3- | D.NH4+、MnO4-、H+、K+ |
下列离子方程式中,正确的是
| A.稀硫酸滴在铜片上: Cu + 2H+= Cu2++ H2↑ |
| B.氧化镁与稀盐酸混合: MgO + 2H+= Mg2++ H2O |
| C.铜片插入硝酸银溶液中:Cu + Ag+= Cu2++ Ag |
| D.铁与稀硫酸反应: 2 Fe + 6H+ = 2Fe3+ + 3H2↑ |