请按要求书写下列反应方程式:
(1)用消石灰和氯化铵固体共热制取氨气,请写出其反应的化学方程式:
。
(2)常温下,二氧化硅与氢氟酸反应,请写出其反应的化学方程式:
。
(3)将红热的木炭投入到浓硫酸中,请写出其反应的化学方程式:
。
(4)氢氧化亚铁在空气中由白色经灰绿色变为红褐色,请写出其反应的化学方程式:
。
(5)氨的催化氧化,请写出其反应的化学方程式:
。
(6)将 氯气通入水中,请写出其反应的离子方程式:
氯气通入水中,请写出其反应的离子方程式:
。
(7)向氢氧化铝沉淀滴入氢氧化钠溶液至过量,请写出其反应的离子方程式:
。
(8)向FeCl2溶液中滴入氯水,请写出其反应的离子方程式:
。
(9)向硅酸钠溶液中通入过量的CO2,请写出其反应的离子方程式:
。
(10)将铜片放入在FeCl3溶液中,请写出其反应的离子方程式:
。
(本题12分)化合物M是一种治疗心脏病药物的中间体,以A为原料的工业合成路线如下图所示。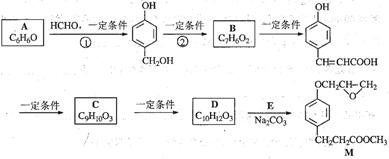
已知:RONa+ R’X→ROR’+ NaX
根据题意完成下列填空:
(1)写出反应类型。反应①反应②
(2)写出结构简式。AC
(3)写出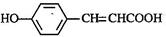 的邻位异构体分子内脱水产物香豆素的结构简式。
的邻位异构体分子内脱水产物香豆素的结构简式。
(4)由C生成D的另一个反应物是,反应条件是。
(5)写出由D生成M的化学反应方程式。
(6)A也是制备环己醇(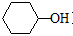 )的原料,写出检验A已完全转化为环己醇的方法。
)的原料,写出检验A已完全转化为环己醇的方法。
(本题8分)异丙苯(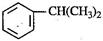 ),是一种重要的有机化工原料。
),是一种重要的有机化工原料。
根据题意完成下列填空:
(1)由苯与2-丙醇反应制备异丙苯属于反应;由异丙苯制备对溴异丙苯的反应试剂和反应条件为。
(2)异丙苯有多种同分异构体,其中一溴代物最少的芳香烃的名称是。
(3)α-甲基苯乙烯(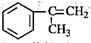 )是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。
)是生产耐热型ABS树脂的一种单体,工业上由异丙苯催化脱氢得到。写出由异丙苯制取该单体的另一种方法(用化学反应方程式表示)。
(4)耐热型ABS树脂由丙烯腈(CH2=CHCN)、1,3-丁二烯和α-甲基苯乙烯共聚生成,写出该树脂的结构简式(不考虑单体比例)。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在溶积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);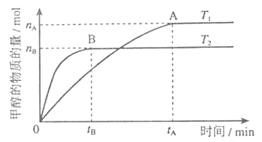
下列说法正确的是________(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为
v(CH3OH)= 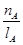 mol·L-1·min-1
mol·L-1·min-1
②该反应在T时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为______;
(5)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为________、正极的反应式为________。理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________________;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________mol·L-1(Ksp[Cu(OH)2]=2.2×10-20)。
若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
乙烯是一种重要的化工原料,以乙烯为原料衍生出部分化工产品的反应如下(部分反应条件已略去):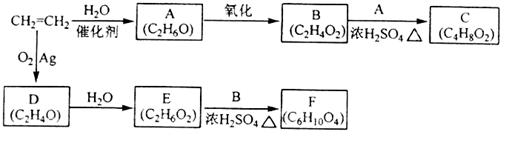
请回答下列问题:
(1)A的化学名称是_______;
(2)B和A反应生成C的化学方程式为___________,该反应的类型为_____________;
(3)D的结构简式为___________;
(4)F的结构简式为_____________;
(5)D的同分异构体的结构简式为___________。