( 10分)在密闭容器中进行下列反应:CO2(g)+C(s)  2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
2CO(g) ΔH>0,起始通入2molCO,达到平衡后,改变下列条件,则指定物质的浓度、百分含量(填“不变”“增大”“减小”)及平衡如何变化(填“正移”“逆移”“不移动”):
(1)增加C,平衡________,c(CO)________。
(2)减小密闭容器的体积,保持温度不变,则平衡______________,c(CO2)___ _____。
(3)通入N2,保持密闭容器的体积和温度不变,则平衡________,c(CO2)________。
(4)保持密闭容器的体积不变,升高温度,则平衡__________________,c(CO)________
(5)恒压通入N2,CO2的百分含量
(6)恒压再通入2molCO,CO2的百分含量
如图每一方框中的字母代表一种反应物或生成物。产物J是含金属元素A的白色胶状沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白。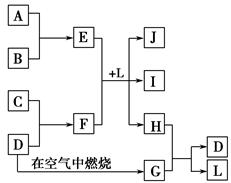
(1)框图中所列物质中属于非电解质的物质的化学式是。
(2)用电子式表示出H的形成过程。
(3)将E的水溶液蒸干并灼烧得到的固体物质的化学式为。
(4)F的水溶液中各离子浓度由大到小的顺序为。
(5)F的水溶液显碱性的原因:(用离子方程式表示)。
(6)E与F在L中反应的离子方程式为。
(7)H和G之间反应的化学方程式为。
在化学课上围绕浓硫酸的化学性质进行了如下实验探究,将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后加入浓硫酸,生成黑色物质。
请回答下列问题:
(1)生成的黑色物质(单质)是(填化学式)。
(2)这种黑色物质继续与浓硫酸作用会产生两种气体,其中一种气体有刺激性气味,是大气的主要污染物之一,这种刺激性气味的气体成分是(填化学式),反应的化学方程式为。
(3)据蔗糖与浓硫酸反应的实验现象,说明浓硫酸具有(填序号)。
| A.酸性 | B.吸水性 | C.脱水性 | D.强氧化性 |
(4)将(2)中产生的有刺激性气味的气体通入品红溶液中,可以看到品红溶液,说明这种气体具有性;将(2)中产生的有刺激性气味的气体通入水中可生成一种不稳定、易分解的酸,请写出该反应的化学方程式:。
(5)能否用澄清石灰水鉴别这两种气体?(填“能”或“不能”),若不能,请填写两种能鉴别的试剂。
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g样品与2.0 mol·L-1 NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示。请回答下列问题: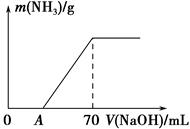
(1)A点前样品与NaOH反应的离子方程式为。
(2)为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的(填字母序号)。
(3)样品中(NH4)2CO3的质量分数是%(保留一位小数)。
(4)当V(NaOH)=50 mL时,生成NH3的质量为。
下图中A~J分别代表相关反应的一种物质。已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:
(1)A的化学式。
(2)定出反应①②的化学方程式:
①,
②。
(3)写出反应③的离子方程式:。
(4)J与F反应的化学方程式:。
(5)在反应④中,当生成标况下2.24 L G时,转移电子数为mol。
工业上可用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,先把铜屑在空气中灼烧,再跟用等体积水稀释的浓硝酸反应来制取硝酸铜。请回答下列问题:
(1)不宜于用铜屑直接与硝酸反应来制取硝酸铜的原因是。
(2)浓硝酸用等体积水稀释的目的是。
(3)要得到硝酸铜晶体,应选用。
(4)反应中硝酸表现出性。