工业上可用铜屑和浓硝酸为原料制取硝酸铜。在实际生产中,先把铜屑在空气中灼烧,再跟用等体积水稀释的浓硝酸反应来制取硝酸铜。请回答下列问题:
(1)不宜于用铜屑直接与硝酸反应来制取硝酸铜的原因是 。
(2)浓硝酸用等体积水稀释的目的是 。
(3)要得到硝酸铜晶体,应选用 。
(4)反应中硝酸表现出 性。
为了达到下表中的实验要求,请从供选择的化学试剂及实验方法中选出合适的,将其标号填入对应的空格中。
| 实验要求 |
选项的标号 |
| 除去FeCl3溶液中的FeCl2 |
|
| 从碘水中提取碘单质 |
|
| 提纯混有少混NaCl的KNO3 |
|
| 鉴别NaCl和KCl |
供选择的化学试剂或实验方法如下:
A、加热灼烧,观察
B、在较高温度下溶于水配成浓溶液,再冷却结晶
C、加入四氯化碳萃取
D、加入适量的铁屑
E、通入Cl2气体
某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、A12O3等杂质)提取Fe2O3。操作讨程如下: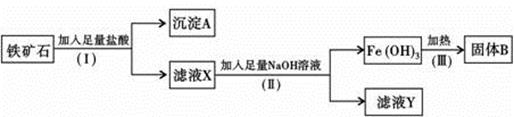
(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是;
(2)沉淀A中主要含有,固体B是;
(3)取少量滤液X于试管中滴入几滴KSCN溶液可观察到溶液变成色,滤液Y中的阴离子除OH-、Cl-外,还有;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式
(12分)针对下面10种元素,完成以下各小题。
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
C |
N |
O |
Ne |
||||
| 3 |
Na |
Mg |
Al |
Si |
S |
Cl |
(1)常温下,会在浓硫酸中发生钝化的金属是(填名称)。
(2)化学性质最不活泼的元素是(填元素符号)。
(3)镁的原子结构示意图为。
(4)C与N相比,原子半径较小的是。
(5)最高价氧化物对应的水化物酸性最强的是碱性最强的是(填化学式)。
(6)常用于制半导体材料的元素是。
(7)H2S和HCl相比,热稳定性较强的是。
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式,其中硫元素和氧元素的质量比m(S): m(O)= 。
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:
氨在人类的生产和生活中有着广泛的应用
(1)下列含氮物质属于盐的是属于非电解质的是。
| A.NH3 |
| B.NH3•H2O |
| C.NH4NO3 |
| D.HNO3 |
E.N2
(2)0.1 mol的N2H4气体和0.2molNH3气体,它们在同温、同压下的体积比是,所含的原子数比是。
(3)氨气溶解于水,得到的溶液称为氨水。氨溶解于水时与水发生反应生成一水合氨(NH3·H2O),它是一种弱碱。写出一水合氨的电离方程式。从上述电离方程式可知,往氨水中加入稀硫酸生成的盐是(填化学式)
(4)标准状况下,将 2.24L的氨气溶于水配成 0.5L溶液,所得溶液的物质的量浓度为mol/L。
(5)氨可与Cl2反应,反应方程式如下:8NH3+3Cl2=6NH4Cl+N2,利用该反应的原理,在工业上可用于检验输送氯气的管道是否漏气。该反应中,__________是还原剂;若反应中有1.5mol氧化剂参与反应,则发生转移的电子的物质的量为____________mol,被氧化的物质有mol。
(1)氢气被看做是理想的“绿色能源”。用高压氢气、氧气制作氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的电极反应式。
正极;
负极。
(2)电解原理在化学工业中有广泛应用。下图表示一个电解池,其中a为电解质溶液,X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: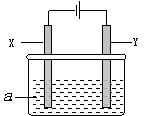
①Y的电极名称是(填写“阳极”或“阴极”)。
②若X、Y都是惰性电极,a是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞试液,一段时间后,在X极附近观察到的现象是,如何检验Y极上的产物:。(试剂及现象)
(3)若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阳极上产生气体的体积为4.48L(标 准状况下),则阴极上析出金属的质量为g。
(4)若要用该装置电解精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是,Y电极的材料是。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的方案是。
| 方案 |
X |
Y |
a溶液 |
| A |
铁 |
银 |
AgNO3 |
| B |
铁 |
银 |
Fe(NO3)3 |
| C |
银 |
铁 |
AgNO3 |
| D |
银 |
石墨 |
AgNO3 |