【原创】(10分)脱羧反应形成新的C-C键为有机合成提供了一条新的途径,例如:
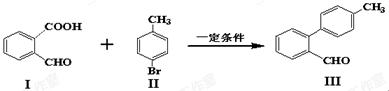
(1)化合物I含有的官能团名称是______________。
(2) 与
与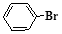 也能发生脱羧反应,有机产物的结构简式为 。
也能发生脱羧反应,有机产物的结构简式为 。
(3)化合物III与新制氢氧化铜反应的化学方程式为 。
(4)下列有关化合物Ⅲ的说法正确的是 。
| A.化合物无Ⅲ分子式为C14H15O |
| B.1mol化合物Ⅲ最多可以与6mol H2反应 |
| C.化合物无Ⅲ分子中的所有碳原子一定处于同一平面 |
| D.化合物Ⅲ既可以发生氧化反应和还原反应,也可以发生加成反应和取代反应 |
(5)写出符合下列条件的化合物的同分异构体 。
①化合物I的最简单同系物
②苯环上有两种不同类型的氢原子
红磷P(s)和Cl2(g)发生反应,生成PCl3(g)和PCl5(g)。反应过程和能量的关系如图所示(图中△H表示生成1 mol 产物的数据)。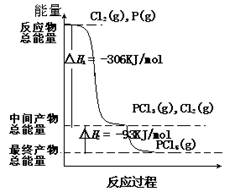
根据图回答下列问题:
(1)P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式:
(2)PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:____________________;
(3)上述分解反应是一个可逆反应。温度T1时,在体积为1L的密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60mol,其分解率α1等于,平衡常数K1等于;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,平衡常数为K2,则α2α1,
K2K1。(填“大于”、“小于”或“等于”)
(4)P和Cl2分两步反应生成1mol PCl5的△H3 =
已知A、B、C、D都是短周期元素,它们的原子半径大小为B>C>D>A。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子有2个未成对电子。A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。E是第四周期元素,其原子核外最外层电子数与A原子相同,其余各层电子均充满。回答下列问题(用元素符号或化学式表示)。
(1)M分子中B原子轨道的杂化类型为。
(2)化合物CA3的沸点比化合物BA4的高,其主要原因是。
(3)写出与BD2互为等电子体的C3-的结构式。
(4)E+的核外电子排布式为,下图是D、E形成的某种化合物的晶胞结构示意图,该晶体1个晶胞中阳离子的个数为。
(5)向E的硫酸盐溶液中通入过量的CA3,可生成[E(CA3)4]2+配离子,1 mol [E(CA3)4]2+中含有σ键的数目为。
金属镁可用于制造合金、储氢材料、镁电池等。
已知:①C(s)+O2(g) CO(g) ΔH="-110.5" kJ·mol-1②Mg(g)+O2(g)
CO(g) ΔH="-110.5" kJ·mol-1②Mg(g)+O2(g) MgO(s) ΔH="-732.7" kJ·mol-1
MgO(s) ΔH="-732.7" kJ·mol-1
(1)一种制备镁的反应为MgO(s)+C(s) Mg(g)+CO(g),该反应的ΔH=。
Mg(g)+CO(g),该反应的ΔH=。
(2)一种用水氯镁石(主要成分为MgCl2·6H2O)制金属镁工艺的关键流程如下:
①为探究MgCl2·6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2·6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。测得E中Mg元素质量分数为60.0%,则E的化学式为。 “一段脱水”的目的是制备MgCl2·2H2O,温度不高于180 ℃的原因是。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。 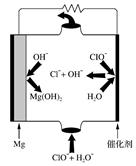
(3)Mg2Ni是一种储氢材料。2.14 g Mg2Ni在一定条件下能吸收0.896 L H2(标准状况下)生成X,X的化学式为。
(4)“镁-次氯酸盐”燃料电池的装置如右图所示,该电池反应的电极反应式分别为负极。 正极
水滑石(MgaAlb(OH)c(CO3)d·xH2O)用作阻燃剂及催化剂的载体
(1)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为。
(2)为确定水滑石的组成,进行如下实验:取水滑石样品60.2g进行加热时,温度与剩余固体质量的关系如图。认真分析图中曲线变化情况回答下列问题(已知样品在400℃时已完全失水)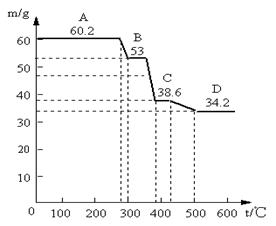
①当温度在0~280℃质量不变,是什么原因:。C→D减少的物质其物质的量为
②该水滑石的化学式为(写出计算过程)
某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质。利用拜耳法生产氧化铝的流程如下图所示: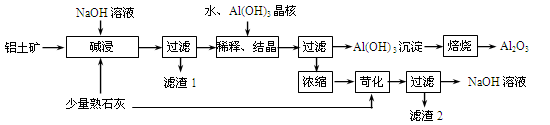
(1)碱浸时为提高铝土矿的浸出率可采取的措施是,。(答两点)
(2)AlO(OH)与NaOH反应的化学方程式为。
(3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出。上述“稀释、结晶”工艺,也可用通入足量的某气体的方法来代替。通入气体时发生反应的离子方程式是.
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:。
(5)该生产流程能实现(填化学式)的循环利用。
(6)氧化铝是工业上冶炼铝的原料,用氧化铝电解制备金属铝时需加入冰晶石(Na3AlF6)作助熔剂,写出用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为 。