【原创】Ⅰ.(6分)在某盐甲的溶液中加入NaOH溶液,加热,会产生能使酚酞试液变红的气体乙;若在盐甲溶液中加入铜片和稀盐酸,则会产生无色气体,该气体遇空气变红棕色。
(1)盐甲中阳离子的电子式 。
(2)气体乙使酚酞试液变红原因是 。(用电离方程式表示)
(3)写出盐甲与铜片和稀盐酸反应的离子的方程式 。
Ⅱ.(12分)某种无机矿物的主要成分M含有五种元素,且含有结晶水。为了探究M的化学式,某化学兴趣小组做了下列实验:

(1)M的化学式为 。反应中生成红褐色沉淀的离子方程式为 。
(2)写出溶液1与过量CO2反应的离子方程式 ;实验中要将红褐色沉淀灼烧后再称量的原因是 。
(3)将白色沉淀1充分灼烧可得固体X。固体X与氯气混合加热可能发生氧化还原反应,写出一个可能的化学反应方程 ,并设计实验方案验证该反应的固体的产物 。
【命题立意】与近几年高考试题相比,预测无机综合题难度可能会有所加大,基于此考虑,本题的第Ⅱ小题综合性较强,难度较大,意在对学生获取和处理信息的能力、分析和解决化学问题的能力和实验探究能力进行综合考查。定性与定量分析的巧妙设计、化学反应的推测、实验设计与评价是本题的主要亮点。
已知①卤代烃(或 -Br)可以和金属反应生成烃基金属有机化合物。后者又能与含羰基化合物反应生成醇:
-Br)可以和金属反应生成烃基金属有机化合物。后者又能与含羰基化合物反应生成醇:
RBr+Mg RMgBr
RMgBr RCH2OMgBr
RCH2OMgBr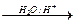 RCH2OH
RCH2OH
②有机酸和PCl3反应可以得到羧酸的衍生物酰卤:
③苯在AlCl3催化下能与卤代烃作用生成烃基苯: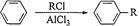
有机物A、B分子式均为C10H14O,与Na反应放出H2并均可经上述反应合成,但却又不能从羰基化合物直接加氢还原得到。A与浓硫酸并加热可得到C1和C2,而B得到D1和D2。C1、D1分子中所有碳原子均可能共处于同一平面上,而C2和D2却不可能。请以最 基本的石油产品(乙烯、丙烯、丙烷、苯等)和
基本的石油产品(乙烯、丙烯、丙烷、苯等)和 任选无机试剂为原料依下列路线合成B,合成B的路线为:
任选无机试剂为原料依下列路线合成B,合成B的路线为:
则写出下列物质的结构简式:
A:_____________;B:_____________;C2:_____________;D1:_____________;
1:_____________;2:_____________;3:______________;4 :______________;
:______________;
5:_____________;6:_____________;7:_______________;8:________________;9:______________。
在某温度下合成氨:N2+3H2 2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
2NH3(△H<0),把N2和H2以1︰1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器容积固定),在保持同温度下,A、B两个容器的合成氨反应先后达到平衡状态。请回答:
(1)写出该反应的平衡常数表达式:_____________,KA_____ _KB(填“>”、“<”或“=”)。
_KB(填“>”、“<”或“=”)。
(2)平衡常数K值越大,表明建立平衡时__________。
A.N2的转化率越低 B.NH3的产量越小
C.正反应进行得越彻底
(3)欲增大该反应K值,可以采取的措 施为__________。
施为__________。
A.升高温度 B.降低温度
C.增大N2、H2的浓度 D.使用高效的催化剂
(4)分析下表中数据后,完成下列问题[M(平)表示平衡 时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占
时混合物的平均相对分子质量]:达平衡时,容器A中N2的转化率为___________,容器B中M(平)为__________,容器______(填“A”或“B”)中,NH3的物质的量所占 的比例较大。
的比例较大。
| 容器A |
容器B |
|
| M(平) |
20 |
|
| 平衡时N2的转化率 |
10% |
已知A是来自石油的重要有机化工原料,E是具果香味的有机物,F是一种高聚物,可制成多种包装材料。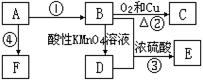
(1)A的最简式为:____________,C的名称:_____________,F的结构简式:____________________________________。
(2)D分子中的官能团名称是_________________,请设计一种实验来验证D物质存在该官能团的方法是_________________________________________。
(3)写出下列反应的化学方程式并指出反应类型:③____________________________,反应类型_____________。
新合成的一种烃,其碳架呈正三棱柱(如图所示)
(1)写出该烃的分子式_____________________________。
(2)该烃的一氯代物是否有同分异构体?_______。(填“是”或“否”)
(3)该烃的二氯取代物有_________________种。
(4)该烃的同分异构体有多种,其中一种不能使酸性高锰酸钾溶液或Br2的CCl4溶液褪色,但在一定条件下能跟溴发生取代反应,和H2能发生加成反应,这种同分异构体的结构简式是_______________________________。
短周期元素的单质X、Y、Z在通常状况下均为气态,并有右图转化关系(反应条件略去),已知: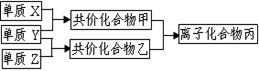
a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______________________。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。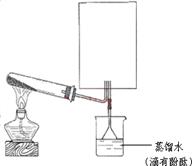
①在图中方框内绘出收集甲的仪器装置简图。
②试管中的试剂是____________________。(填写化学式)
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)_________________________。 (3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是__________。