生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(2)根据等电子原理,写出CO分子结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
a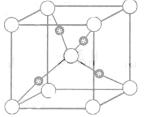
①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ 键的数目为 。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
(1)大气中SO2含量过高会导致雨水中含有(填化学式) 而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为。
(2)已知NaHSO3的水溶液显酸性,比较其中SO32-、HSO3-、H2SO3三种粒子的浓度:> > 。
(3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
(4)已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp (BaCO3)=2.6×10-9。下列说法不正确的是
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零
如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是极,材料是,A电极反应为。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为。
在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)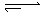 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) |
0 |
20 |
40 |
60 |
80 |
100 |
| c(A) |
0.20 |
0.14 |
b |
0.09 |
0.09 |
0.09 |
| c(B) |
0.00 |
0.12 |
0.20 |
c |
d |
e |
(1)m=,表中bc(填“<”、“=”或“>”)。
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度____________0.09 mol/L(填“<”、“=”或“>”)。
(3)在80℃时该反应的平衡常数K值为(保留1位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时。
①A的转化率越高②A与B的浓度之比越大
③B的产量越大④正反应进行的程度越大
下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
| X |
Y |
Z |
|
| R |
|||
| W |
|||
| J |
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的基态电子排布式为
__________________________________________________________________________;
(3)在X、Y、Z三种元素中,第一电离能由大到小的顺序是______________________;
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为___________________________________________。
淀粉和蛋白质都是重要的营养物质,它们都能发生水解反应。
(1)蛋白质水解的最终产物是(填名称)。
(2)为证明淀粉已经开始水解,可在水解液中依次加入溶液与溶液进行检验,现象是。