(6分)四种短周期元素的微粒信息如下表:
| 元素代号 |
Q |
R |
X |
Z |
| 微粒信息 |
离子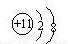 |
单质分子R2 |
离子:X3+ |
一种原子816Z |
已知Q、R、X在同一周期,R2在常温常压下为气态。完成下列填空:
(1)Q位于周期表第----周期----族。化合物Q2Z的电子式为 (元素符号表示)
(2)Q、R、X的原子半径由大到小的顺序为 。Q、R、X、Z中金属性最强的是 (元素符号表示)
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为
7分)某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下:(写出最佳答案)
(1)写出沉淀的化学式:沉淀1,白色沉淀2,
沉淀3;
(2)写出混合液加入A的离子方程式
(3)溶液加入B的离子方程式
已知:
| 溶解度 |
 |
C1- |
OH- |
| Ba2+ |
不溶 |
可溶 |
可溶 |
| Cu2+ |
可溶 |
可溶 |
不溶 |
| Ag+ |
微溶 |
不溶 |
不存在 |
在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。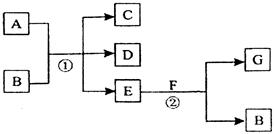
回答下列问题:
(1)A、G的化学式分别为___ ___、______。
(2)A和E反应的离子方程式为______。
(3)写出反应①的化学方程式,并用双线桥法表示出电子转移的情况______。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ____g。
已知X为Fe2O3和CuO的混合物,且知氧化性顺序:Fe3+>Cu2+>H+>Fe2+。取X样品进行如下图所示的实验: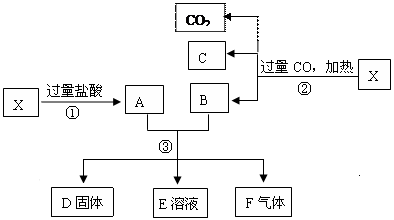
(1)写出③步可能发生反应的离子方程式为 。(共有3个)
(2)若溶液E中只有一种金属离子,则一定是;若溶液E含有两种金属离子,则一定是。
(3)若D固体是纯净物,该固体是。(填化学式)
(4)印刷电路板是由高分子材料和铜箔复合而成,可用FeCl3溶液作“腐蚀剂”刻制印刷电路的离子反应方程式为。
常温下,某未知酸性溶液中,可能含有大量的Cl-、OH-、CO32-、H+、Ag+、Fe3+ 等离子。你认为其中一定含有的离子是,一定不含有的离子是,还需进一步检验的离子是,为了进一步确认是否含该离子,需要的试剂和现象为。
1mol Na2SO4的质量为克,含有个氧原子,其水溶液的电离方程式为。