用碳棒作电极,在H+、Na+、Cu2+、Ag+、Cl-、NO3-、SO42-等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(1)当阴极放出H2,阳极放出O2时,电解质是 ;
(2)当阴极析出金属,阳极放出O2时,电解质是 ;
(3)当阴极放出H2,阳极放出Cl2时,电解质是 ;
(4)通过电子的物质的量与阴极析出的金属、阳极析出的气体的物质的量之比为4∶2∶1时,电解质的化学式是 。
目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = _______________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为________________________________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = _________________________。
(6)下列说法不正确的是____________________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
IV.(7)电解CO制备CH4和W,工作原理如图所示,其原理用电解总离子方程式解释是_____________。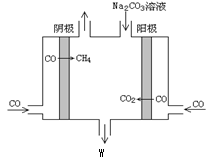
【化学选修3:物质结构与性质】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| A |
原子核外L层电子数是K层的2倍 |
| B |
其一种单质被称为地球生物的“保护伞” |
| C |
元素的第一电离能是第3周期所有元素中最小的 |
| D |
基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E |
可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是。
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同),B、D的简单氢化物中稳定性较大的是。
(3)B的常见单质和C的单质按物质的量比1∶2反应生成的化合物中化学键的类型为;该化合物属于晶体。
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是。
(5)已知:2AB(g)+B2(g) 2AB2(g) ΔH="-566.0" kJ·mol-1
2AB2(g) ΔH="-566.0" kJ·mol-1
D(s)+B2(g) DB2(g)ΔH="-296.0" kJ·mol-1
DB2(g)ΔH="-296.0" kJ·mol-1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式:。
【化学选修2:化学与技术】火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸: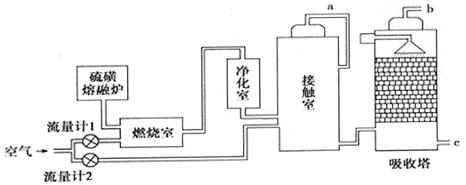
请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面_(可多选)
| A.橡胶的硫化 |
| B.表面活性剂“烷基苯磺酸钠”的合成 |
| C.铅蓄电池的生产 |
| D.过磷酸钙的制备 |
(2)为充分利用反应放出的热量,接触室中应安装______(填设备名称)。吸收塔中填充有许多瓷管,其作用是 .
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是_______;。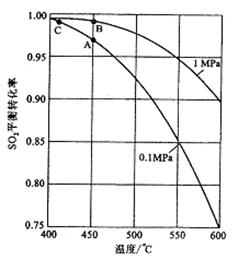
(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为(空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是。
氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
| 反应 |
大气固氮 N2(g)+O2(g)  2NO(g) 2NO(g) |
工业固氮 N2(g)+3H2 (g)  2NH3(g) 2NH3(g) |
|||
| 温度/℃ |
27 |
2000 |
25 |
400 |
450 |
| K |
3.84×10-31 |
0.1 |
5×108 |
0.507 |
0.152 |
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。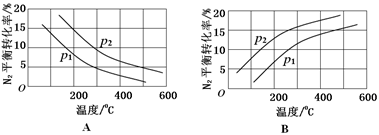
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是。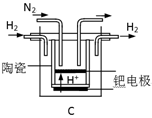
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为;
(2)用晶体的X射线衍射法可以测得阿伏加德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361 pm。又知铜的密度为9.00 g·cm-3,则铜晶胞的体积是cm3、晶胞的质量是g,阿伏加德罗常数为(列式计算,已知A1(Cu)=63.6);
(3)氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为。已知其中一种化合物的化学式为KCuCl3,另一种化学式为;
(4)金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是,反应的化学方程式为。