A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去)。
⑴ 若A是一种黄色单质固体,则B→C的化学方程式为 。
⑵ 若A是一种活泼金属,C是淡黄色固体,则C的名称为 ,C可用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用,请用化学方程式表示该反应原理 。
⑶若A为能使湿润的红色石蕊试纸变蓝的气体,C是红棕色气体,且B和C易在空气形成光化学烟雾。
①则A为 ,C为 ,(填写化学式)
实验室用熟石灰与氯化铵固体共热制取A,写出此化学方程式: 。
②写出C与水反应的化学方程式: 。
在室温和大气压强下,用图示的装置进行实验,测得
含
90%的样品与水完全反应产生的气体体积
。现欲在相同条件下,测定某电石试样中
的质量分数,请回答下列问题: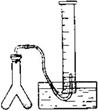
(1)
和水反应的化学方程式是。
(2)若反应刚结束时,观察到的实验现象如图所示,这时不能立即取出导气管,理由是。
(3)本实验中测量气体体积时应注意的事项有。
(4)如果电石试样质量为
,测得气体体积为
,则电石试样中
的质量分数计算式
(
)=。(杂质所生成的气体体积忽略不计)。
以下是某同学测定硫酸钠晶体中结晶水含量的实验方案。
实验用品:硫酸钠晶体试样、研钵、干燥器、坩埚、三脚架、泥三角、玻璃棒、药匙、托盘天平
实验步骤:
①准确称量一个干净、干燥的坩埚;
②在坩埚中加入一定量的硫酸钠晶体试样,称重,将称量过的试样放入研钵中研细,再放回到坩埚中;
③将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至两次称量结果不变;
⑥根据实验数据计算硫酸钠晶体试样中结晶水的质量分数。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是;
(2)指出实验步骤中存在的错误并改正:;
(3)硫酸钠不能放置在空气中冷却的原因是;
(4)步骤⑤的目的是;
(5)下面的情况有可能造成测试结果偏高的是(填序号)。
| A. | 试样中含有加热不挥发的杂质 |
| B. | 试样中含有加热易挥发的杂质 |
| C. | 测试前试样已有部分脱水 |
| D. | 实验前坩埚未完全干燥 |
E.晶体加热脱水不完全
F.加热时晶体溅出
一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0 ,与反应前的体积相比,反应后体积缩小的百分率是()
| A. | 16.7 | B. | 20.0 |
| C. | 80.0 | D. | 83.3 |
水蒸气通过灼热的焦炭后,流出气体一的主要成分是
和
,还有
和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有
和
。(加热装置和导管等在图中略去)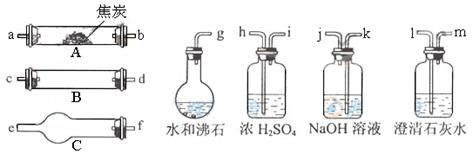
回答下列问题:
(1)盛浓
的装置用途是。
盛 溶液的装置用途是。(2)仪器B中需加入试剂的名称(或化学式)是:。
所发生反应的化学方程式是:。
(3)仪器C中需加入试剂的名称(或化学式)是:。
其目的是。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:
。
(5)能证明混合气体中含
的依据是。能证明混合气体中含
的依据是。
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用右图的装置制备乙酸乙酯。
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作
用是:。
(2)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管II再测有机层的厚度,实验记录如下:
| 实验编号 |
试管Ⅰ中试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
3 mL乙醇、2 mL乙酸、1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
5.0 |
| B |
3 mL乙醇、2 mL乙酸 |
0.1 |
|
| C |
3 mL乙醇、2 mL乙酸、6 mL 3mol·L-1 H2SO4 |
1.2 |
|
| D |
3 mL乙醇、2 mL乙酸、盐酸 |
1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是__________mL和__________mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是。