工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
(6分)简要回答下列间题。
(1)自来水生产时,用适量的氯气来杀菌消毒,市场上有些不法商贩用自来水冒充纯净水出售,请你用化学方法将其辨别。
(2)长期存放石灰水的试剂瓶内壁会出现一层白色固体,请解释这一现
象。
(3)“低碳生活”成为新的时尚流行全球,控制C02排放需要从人人做起,
请你提出一种“低碳生活”的举措。
从下列六种有机物中选择合适的答案,将其标号填在空格内
| A.苯 |
| B.乙醇 |
| C.乙酸 |
| D.油脂 |
E.葡萄糖
F.蛋白质
(1)食醋可作为增加食品酸味的调味剂,是因为其中含有
(2)属于天然有机高分子化合物的是。
(3)医疗消毒常用75%(体积分数)的溶液。
(4)花生油、茶籽油、牛油的主要成分是。
(5)家居装修材料会散发出甲醛、等挥发性的有害物质。
(6)在某病人的尿样中加人新制氢氧化铜悬浊液,加热后有红色沉淀生成,
说明该尿样中含有。
(6分)完成下列各题。
(1)“可燃冰”是天然气的水合物,外形似冰,它的主要可燃成分是甲烷,写出甲烷燃烧的化学方程式_________________
(2)碳酸氢钠可用作治疗胃酸(主要含盐酸)过多的药剂,写出该反应的化学方程式_______________________________
(l2分)下表是元素周期表的一部分,根据所给的10 种元素,回答下列
问题。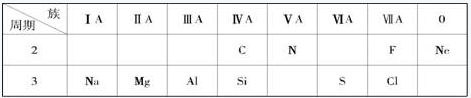
(1)非金属性最强的元素是;
(2)Ne 原子结构示意图为;
(3)C 与N 中,原子半径较小的是;
(4)氯水具有漂白作用,是由于其中含有(填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是(填化学式),呈两性的是(填化学式);
(6)元素硅的氧化物常用于制造(填一种高性能的现代通讯材料的
名称);
(7)右图 为某有机物的球棍模型(其中
为某有机物的球棍模型(其中 代表氢原子代表
代表氢原子代表 碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=。(相对原子质量C-12、H-l)
碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)=。(相对原子质量C-12、H-l)
(8)镁是制造汽车、飞机、火箭的重要材料。写出工业上电解熔融氯化镁获得金属镁的化学方程式。
(4分)我国政府十分关注学生营养状况,把每年5月20日确定为“中国学生营养日”。右表为某山区学校食堂午餐的食谱。请用所学的化学知识填写空格:
(l)食谱中的米饭主要含(填“淀粉”或“纤维素”)。
(2)从营养均衡及学生身体发育需要的角度考虑,你认为以上食谱中应增加富含蛋白质的食物是(只填一种)。