以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。
| 难溶物 |
Ksp |
| Ca3(AsO4)2 |
6.8×10-19 |
| AlAsO4 |
1.6×10-16 |
| FeAsO4 |
5.7×10-21 |
| 污染物 |
H2SO4 |
As |
| 浓度 |
28.42 g/L |
1.6 g·L-1 |
| 排放标准 |
pH 6~9 |
0.5 mg·L-1 |
表1.几种砷酸盐的Ksp 表2.工厂污染物排放浓度及允许排放标准
回答以下问题:
⑴该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
⑵写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]= ,若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol·L-1,c(AsO43-)最大的是 mol·L-1。
⑶工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式 。
⑷在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为 。
根据下列有机化合物,回答问题。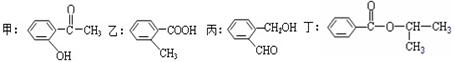
(1)上述互为同分异构体的化合物为 ;
(2)写出丙中官能团的名称 ;
(3)丁在一定条件下,可以发生水解反应,生成X、Y两种物质(相对分子质量:X<Y)。由X经下列反应可制得N、F两种高分子化合物,它们都是常用的塑料。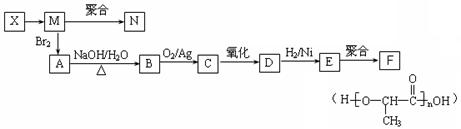
①X转化为M的反应类型是 。
②写出B转化为C的化学方程式 ;
③在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式为
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层 只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 ;
(3)A的最高价含氧酸根离子中,其中心原子采取 杂化,D的低价氧化物分子的空间构型是 。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为 ;(每个球均表示1个 原子)
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准。
(1)含铬废水排放到河水中一定浓度会使鱼类等水生动物死亡的原因是 ;
(2)铬元素以Cr2O72-的形式存在于酸性废水中,常用FeSO4将其还原为Cr3+,再用沉淀法进行分离。
|
|
已知:Cr3+ Cr(OH)3
Cr(OH)3 CrO2-
CrO2-
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去):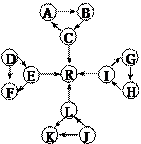
已知:①图中每个小三角形的三种物质中至少含有一种相同
元素,K与L含有完全相同的元素。②D、J为固体单质,
R为气体单质,其余物质为常见化合物。③A能使品红溶液
褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E
与C或L反应都能生成R。⑤I为氧化物,I与F或C都能
反应;G和L反应生成难溶物H,H具有较强的吸附性。根
据以上信息,回答下列问题:
(1)写出下列反应的化学方程式:
①C→A:
②L→R:。
(2)写出下列反应的离子方程式:①E→F:
②I→G:。
(3)常温下,测得一定浓度G溶液的pH=10,试用离子方程式表示其原因:。
A、B、C、D都是短周期元素,原子半径:D > C > A > B。已知:A、B同周期,A、C处于同一主族;C原子核内的质子数等于A、B原子核内的质子数之和;C原子最外层电子数是D原子最外层电子数的3倍。试回答:
(1)写出元素A的名称: A 。
(2)写出由B、D组成的两种化合物的电子式: 、 。
(3)C的固态氧化物属于 晶体。
(4)写出C的氧化物与D的氧化物对应的水化物反应的离子方程式:
。