已知:101kPa时,辛烷的燃烧热为5518kJ·mol-1,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ·mol-1,则下列热化学方程式书写正确的是 ( )
① C8H18(l)+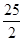 O2(g)= 8CO2(g)+9H2O(g);△H = -5518kJ·mol-1
O2(g)= 8CO2(g)+9H2O(g);△H = -5518kJ·mol-1
② C8H18(l)+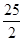 O2(g)= 8CO2(g)+9H2O(l);△H = -5518kJ·mol-1
O2(g)= 8CO2(g)+9H2O(l);△H = -5518kJ·mol-1
③ H+ + OH- =" " H2O;△H = -57.3kJ·mol-1
④ NaOH(aq)+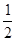 H2SO4(aq)
H2SO4(aq)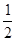 Na2SO4(aq)+H2O(l);△H= +57.3kJ·mol-1
Na2SO4(aq)+H2O(l);△H= +57.3kJ·mol-1
| A.①③ | B.② | C.②④ | D.②③ |
下列关于Fe3+、Fe2+性质实验的说法错误的是
| A.用上图装置可以制备沉淀Fe(OH)2 |
| B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 |
| C.FeCl3溶液中滴加KSCN溶液会生成红色沉淀 |
| D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
某药物中间体X的结构如图所示,下列说法正确的是
| A.该X的分子式为C23H25N2O3 |
| B.每个X分子中含有2个手性碳原子 |
| C.1 mol X最多能与9 mol H2发生加成反应 |
| D.X能发生水解、氧化和消去反应 |
下列有关说法正确的是
| A.为减小酸碱中和滴定的实验误差,锥形瓶必须洗净、烘干后使用 |
| B.在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 |
| C.已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 |
| D.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,可知100 mL 0.1 mol·L-1的盐酸与100 mL 0.1 mol·L-1的氨水混合,放出的热量等于0.573 kJ |
下列关于各图的叙述正确的是
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.乙表示A、B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数ω(B)>ω( A)
C.丙表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度NaB溶液的pH
D.丁表示0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1醋酸溶液得到的滴定曲线
短周期主族元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。Z原子的最外层电子数是X原子内层电子数的3倍,也是Y原子最外层电子数的3倍。X与Y、Z位于相邻的周期。下列说法正确的是
| A.X的最高价氧化物对应的水化物是弱酸 |
| B.元素Z位于元素周期表的第3周期Ⅵ族 |
| C.Y形成的单质能在二氧化碳中燃烧 |
| D.原子半径的大小顺序: r(Z)>r(Y)>r(X) |