当今水体的污染成为人们关注的焦点。利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol·L-1时,溶液中c(PO43-)= mol·L-1。
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 ;与方法一相比,方法二的优点为 。
(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体。现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为 。
(3)工业上也会利用铝粉除去含氮废水中的NO3-。现在处理100m3浓度为2.0×10-4 mol·L-1的NaNO3溶液,加入一定量的2 mol·L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4∶1,求此过程中消耗铝的质量。(写出计算过程,无过程以0分计算)
下图是一个化学过程的示意图。已知甲池的总反应式为:
2CH3OH+3O2+4KOH2K2CO3+6H2O 
(1)请回答图中甲、乙两池的名称。甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:通入O2的电极的电极反应式是。
A(Fe)电极的电极反应式为,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标况下)。
A、B、C、D均为含苯环的化合物,且分子量B>A>C,已知有机物A的结构简式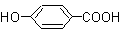
⑴写出A和NaHCO3溶液反应的化学方程式:__________________________________________
⑵有机物B在浓H2SO4存在下,相互作用生成一种环状酯,如下图。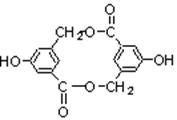
则有机物B的结构简式为___________________,1mol B最多能与_________ mol H2发生加成反应。
⑶ D和B互为同分异构体,且苯环上的一氯代物只有两种,D不与NaHCO3反应,能与Na、NaOH反应,等质量的D消耗Na、NaOH的物质的量之比为2∶3,则D的结构简式有_____种,写出其中一种物质的结构简式___________________。
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH溶液,其正极反应为,负极反应为;
(2)若电解质溶液为硫酸,其正极反应为,负极反应为;
若反应过程中转移了2mol电子,可产生水的质量为g。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)
=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。此时氢氧燃料电池外电路中转移电子数为,消耗H2的质量为。
家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧的热化学方程式:
(8分) 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
| t℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
请回答下列问题:(1)该反应的化学平衡常数K =。
(2)该反应为反应。(填“吸热”或“放热”)
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为℃。
(4)830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为,