I. 维生素C能增强人体对疾病的抵抗能力。
(1)将维生素C溶于水后向溶液中滴加几滴紫色石蕊试液,试液变红,说明维生素C的水溶液呈 性。
(2)维生素C在酸性环境中比较稳定,在高温时易被破坏。请你想一想,如何食用黄瓜,才能充分利用黄瓜种丰富的维生素C?  。
。
II.蛋白质、糖类、无机盐、维生素、油脂、水等被称为 六大营养素。某品牌脱脂奶粉包装袋上标出的配料如下:①脱脂乳②白砂糖③乳酸亚铁④维生素A ⑤维生素D等。请你写出:
六大营养素。某品牌脱脂奶粉包装袋上标出的配料如下:①脱脂乳②白砂糖③乳酸亚铁④维生素A ⑤维生素D等。请你写出:
(1)该产品配料中属于营养素的有  (填编号,下同)。
(填编号,下同)。
(2)人体缺铁,会引起缺铁性贫血,该奶粉中 物质可以补充铁元素。
某化学实验小组从商店买回的浓硫酸试剂标签的部分内容破损。由于试剂瓶口密封签已破损,他们怀疑该硫酸的质量分数与标签不符,决定开展研究。部分破损标签内容为硫酸:化学纯(CP) 品名:硫酸, 化学式:H2SO4相对分子质量:98,质量分数:98%密度:1.98 g/cm3。
甲同学认为,可以用一种精密仪器测量该溶液的c(H+),若c(H+)=36.8 mol·L-1,则该溶液的质量分数为98%。
乙同学认为,即使有精密的仪器,甲同学的方案也不行,建议用重量分析法来测定。具体设想:取一定体积的该硫酸与足量氯化钡溶液反应,过滤、洗涤、干燥沉淀,称量沉淀的质量。
丙同学则建议用中和滴定法进行测定,设想如下:①准确量取一定体积的硫酸,用适量的水稀释;②往稀释后的溶液中滴入几滴指示剂;③用碱式滴定管量取标准浓度的氢氧化钠溶液滴定,直到出现滴定终点为止;④记录消耗的氢氧化钠溶液的体积。
请回答下列问题:(1)乙同学推测甲同学的方案不可行的理由是______________
(2)乙同学的方案的关键操作有两点:①确保SO完全沉淀;②洗涤沉淀,确保沉淀不含杂质。在实际中,洗涤沉淀的操作方法是________________________________________;,
设计简单实验检验SO是否完全沉淀:_________________________________
(3)在丙同学的方案中步骤②用到的指示剂是________;达到滴定终点的标志是________________________________________________________________________。
(4)丙同学的方案中,下列操作对测定结果的影响无法确定的是________。
①在滴定前未用NaOH标准溶液润洗滴定管,②滴定前滴定管尖嘴部分有气泡,滴定后滴定管尖嘴部分仍有气泡,③锥形瓶用蒸馏水洗净后,没有用待测液润洗,④滴定前,仰视读数,滴定后,仍仰视读数,⑤滴定前,仰视读数,滴定后俯视读数
(5)丙同学在实验中,分别取等体积原硫酸,用NaOH溶液滴定三次,终点时,得到的NaOH溶液体积如下表所示:,
| 实验序号 |
硫酸体积 |
NaOH溶液体积 |
NaOH溶液浓度 |
| ① |
5.00 mL |
35.65 mL |
5.00 mol·L-1 |
| ② |
5.00 mL |
39.65 mL |
5.00 mol·L-1 |
| ③ |
5.00 mL |
35.55 mL |
5.00mol·L-1 |
通过计算,确认该浓硫酸质量分数与标签是否相符?________(填“相符”或“不相符”),理由(计算步骤)是______________________________________________________。
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。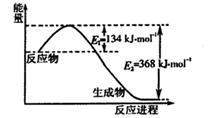
(2)已知:
N2(g)+O2(g)="2" NO(g)△H="+180" kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g )△H="-746" kJ·mol-1
)△H="-746" kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=kJ·mol-1
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g) 2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为,平衡时H2的转化率为,该反应的平衡常数K=。
2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为,平衡时H2的转化率为,该反应的平衡常数K=。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) 2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
则 K1K2(填写“>”、“=”或“<”)
K1K2(填写“>”、“=”或“<”)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是
(填字母)
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变d.. 混合气体的密度保持不变
已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。
(3)在相同温度和压强下,对反应A(g)+B(g)C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| A |
B |
C |
D |
|
| 甲 |
a mol |
a mol |
0 |
0 |
| 乙 |
2a mol |
a mol |
0 |
0 |
| 丙 |
a mol |
a mol |
a mol |
a mol |
| 丁 |
a mol |
0 |
a mol |
a mol |
上述四种情况达到平衡后,C(D)的大小顺序是________。
A.乙=丁>丙=甲B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):________________________________________________________________________。
(5)在恒温恒容条件下进行上述反应。下列情况可以判断该反应达到平衡状态的是____
A.气体平均摩尔质量不再变化 B.气体压强不再变化
C.气体密度不再变化 D.消耗A的速率等于消耗D的速率
E.各组分浓度之比为1:1:1:1 F. C生成的速率等于B消耗的速率
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
(1)由图中信息可知HA为________酸(填“强”或“弱”),理由是____________
(2)常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”),用离子方程式表示其原因为__________________________;,此时,溶液中由水电离出的c(OH-)=________。
(3)请写出K点所对应的溶液中离子浓度的大小关系:__________
(4)K点对应的溶液中,c(M+)+c(MOH)________2c(A-)(填“>”、“<”或“=”);若此时溶液中,pH=10,则c(MOH)+c(OH-)=________mol·L-1。
A、F、G是单质,其中A、F是金属单质,且A是现在用途最广用量最大的金属。F具有黄色的焰色反应,G是黄绿色气体;B、C、D、E是化合物;E到D的现象为白色沉淀变为灰绿色,最后变为红褐色,它们之间存在如下图所示的转化关系(生成物没有全部写出):
(1)推断:A__________F_______(填化学式)
(2)写出E→D的化学方程式____________。
(3)写出C→B的离子方程式________________________。