一定温度下,将3mol A气体和1mol B气体通入一密闭容器中,发生如下反应:3A(g)+B (g) xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4 mol·L-1。
①则1min内,B的平均反应速率为 ,x= ;
②若反应经2min达到平衡,平衡时C的浓度 0.8 mol·L-1 (填“大于”、“等于”或“小于”);
③若平衡混合物中C的体积分数为22%,则A的转化率是 ;
④若改变起始物质的加入量,欲使反应达到平衡时C的物质的量分数与原平衡相等,则起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的条件 (可用两个方程表示,其中一个用n(A)和 n(C),另一个用n(B)和n(C)表示)。
(2)若维持容器压强不变。
①达到平衡时C的体积分数 22%,(填“大于”、“等于”或“小于”);
②若改变起始物质的加入量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入 molA气体 molB气体。
A、B、C为短周期元素,在周期表中所处的位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等。
| A |
C |
|
| B |
(1)A、B、C三种元素的名称分别为、、。
(2)B位于元素周期表中第周期、第族。
(3)C的原子结构示意图为,C的单质与 反应的化学方
反应的化学方
程式为。
(4)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式。
下表为元素周期表的一部分,请回答有关问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)⑤和⑧的元素符号是和。
(2)表中最活泼的金属是,非金属性最强的元素是。(填元素符号)
(3)表中能形成两性氢氧化物的元素是,分别写出该元素形成的单质与⑥、⑨最高价氧化物的水化物反应的化学方程式:、。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:。
(14分)据图回答下列问题: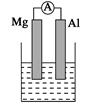
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是 ___________________
负极反应式为:______________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技 术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。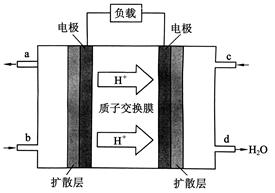
①该电池工作时,b口通入的物质为_______,
c口通入的物质为______。
②该电池负极的电极反应式为:_______
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,______________NA个电子转移。
(12分)我国有广阔的海岸线,海水综合利用大有可为。海水中溴含量为65 mg·L-1,从海水中提取溴的工业流程如下: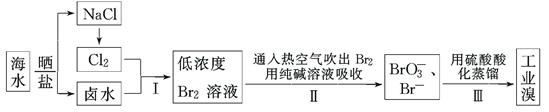
(1)以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:
________________________________________________________________________。
(2)步骤Ⅱ通入热空气或水蒸气吹出Br2,利用了溴的________。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
(4)上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。
写出溴与二氧化硫水溶液反应的离子方程式:________________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是。
(5)实验室分离溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是________。
A.乙醇 B.四氯化碳 C.裂化汽油 D.苯
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为m/2-n。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如下图所示, 丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为。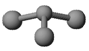
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式)。
(5)写出B与D在高温下完全反应后生成物的电子式___ __,结构式___