(7分)某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H
的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个
甲基,且有三种不同环境的氢原子,
(1)其分子式为______,结构简式为____________。
(2)其同分异构体中与其含有相同官能团的共有___种(不含此有机物,填数字)。
日常饮用水中NO3一的含量是水质卫生检验的重要标准之一,达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
请回答下列问题:
(1)该方案在调节pH时,若pH过大或过小都会造成的利用率降低。
(2)已知过滤后得到的滤液中几乎不含铝元素。①在溶液中铝粉和NO3一反应的离子方程式为。
②滤渣在空气中煅烧过程中涉及的相关反应方程式为
(3)用H2催化还原法也可降低饮用水中NO3—的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
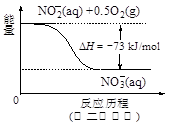
试写出1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是。
(5)固体a熔融电解时阴极反应式为
磷酸盐骨水泥具有良好的生物相容性和生物活性。医药工业利用共沉淀原理,通过控制Ca/P物质的量比n(Ca)/n(P)]制备相应产品[Ca5(PO4)3OH和Ca3(PO4)2的n(Ca)/n(P)分别为1.67和15]流程如下: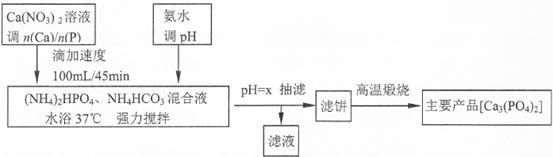
(注:Ca5(PO4)3OH和Ca3(PO4)2和CaHPO4均难溶于水;Ca(H2 PO4)2溶液pH<7)
下表为n(Ca)/n(P)=1.5时,不同pH值制得滤饼的产率以及分析结果:
(1)流程中强调“滴加速度100mL/45min的作用是。流程中调pH选氨水,不选生石灰或石灰乳的理由是。
(2)从表中数据分析生成Ca3(PO4)2时,“pH=x”中的x的最佳取值为,滤饼的化学成分Ca5(PO4)3OH、Ca3(PO4)2和CaHPO4和。
(3)酸性条件下产率偏低的原因是。
(4)“高温煅烧”滤饼,化学反应方程式为。
(5)如图是生产羟基磷灰石时得到的实验曲线,依据图上信息计算磷的初始浓度为0.70mmol/L,pH=10.0条件下反应前10min内磷的沉淀速率为。
汽车尾气中NOx的消除及无害化处理引起社会广泛关注。
(1)某兴趣小组查阅文献获得如下信息:
N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(g)) △H=―483.6kJ/mol
则反应2H2(g)+2NO(g)=2H2O(g)+N2(g) △H=。
(2)该小组利用电解原理设计了如图1装置进行H2还原NO的实验[高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极]。
钯电极A为极,电极反应式为。
(3)氨法催化还原NO原理如下:
主反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g) (△H <0)
4N2(g)+6H2O(g) (△H <0)
副反应:4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
2N2(g)+6H2O(g)
4NH3(g)+ 4O2(g) 2N2O(g)+6H2O(g)
2N2O(g)+6H2O(g)
4NO(g)+4NH3(g)+3O2(g) 4N2O(g)+6H2O(g)
4N2O(g)+6H2O(g)
有关实验结论如图2、图3所示,据此回答以下问题:
①催化还原NO应控制n(NH3)/n(NO)的最佳值为,理由是。
②主反应平衡常数表达式:K=,随着温度的增加,K将(选填“增加”、 “减小”或“不变”。
③影响N2O生成率的因素有、氧气浓度和。
碳酸二甲酯(简称DMC)是一个绿色化学品,可取代光气等有毒物质作为羰基化或甲基化试剂,如:
(1)化合物II核磁共振氢谱有组峰;1mol该物质可以跟mol氢气发生加成反应。
(2)反应①中副产物甲醇发生催化氧化反应的方程式为。
(3)反应②原子利用率100%,则化合物Ⅲ的名称是。化合物Ⅳ的结构简式是,反应③的反应类型是。
(4)化合物V是化合物Ⅱ的一种同分异构体,其苯环上的一氯代物有两种,且能发生水解反应和银镜反应,则化合物V的结构简式为(写其中一种)。
(5)一定条件下, 与DMC1∶1发生类似反应①的反应,请写出反应方程式。
与DMC1∶1发生类似反应①的反应,请写出反应方程式。
利用含锰废水(主要含Mn2+、SO42-、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工业流程如下:
已知某些物质完全沉淀的pH值如下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Cu(OH)2 |
Mn(OH)2 |
CuS |
MnS |
MnCO3 |
| 沉淀完全时的PH |
3.7 |
5.2 |
6.4 |
9.8 |
≥0 |
≥7 |
≥7 |
回答下列问题:
(1)若下列物质均能把Fe2+氧化为Fe3+,则过程①中可选择加入的氧化剂是。
a.Cl2b.MnO2 c.浓HNO3 d.H2O2
(2)过程②中,所得滤渣的成分是。
(3)过程③中,搅拌的目的是,发生反应的离子方程式是。
(4)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3反应的离子方程式是___________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 + O2 → MnO2 + CO2。
O2 → MnO2 + CO2。
现在空气中加热 460.0 g的MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是。(摩尔质量/g·:MnCO3 115 MnO2 87 MnO 71)