(11分)甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题: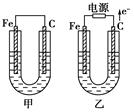
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是_______________________________________________ _。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式__________________________________________。
②甲池中碳极上电极反应式是____________________,乙池中碳极上电极反应属于____________(填“氧化反应”或“还原反应”)。
③若乙池转移0.02 mol e-后停止实验,该池中溶液体积是200 mL,则溶液混匀后的pH=________。
(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是____________ (填“原电池”或“电解池”)。
(2) 写出电极反应式: Pt极______ _ ;当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________________;
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色___________(填“变深”、“变浅”或“无变化”)。
(Ⅱ)燃料电池是燃料(如CO、H2、CH4等)跟O2(或空气)反应,将化学能转化为电能的装置。对于以强碱为电解质的CH4燃料电池,负极电极反应式为:
随着放电的进行,溶液的pH(填“变大”“变小”或“不变”)
(Ⅲ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铜电极、铂电极进行电解实验。
(1)要使电解过程中溶质的组成和质量不变,而该稀溶液的浓度增大,又无浑浊,应以______为阳极电解________溶液,阳极电极反应式为____________________________。
(2)以铂作阳极电解 ________溶液时,溶液的碱性有明显增强,且溶液保澄清,电解的总反应式为 __________________________。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) + 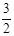 O2(g);△H =" a" kJ·mol—1
O2(g);△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K |
303 |
313 |
323 |
| NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a0;ΔS0,(填“>”、“<”或“=”)
②已知:N2(g) + 3H2(g) 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—1
2H2(g) + O2(g) 2H2O(l)ΔH = -571.6kJ·mol—1
2H2O(l)ΔH = -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
(2)①已知:0.5mol液态肼(N2H4)与足量的液态双氧水反应生成氮气和水蒸气,放出256kJ的热量,写出该反应的热化学方程式
②又已知H2O(g)=H2O(l)△H=-44kJ•mol-1。则32g液态肼与足量的液态双氧水反应生成氮气和液态水时放出的热量是kJ
③此反应用于火箭推进,除释放大量热和快速产生大量气体外还有一个很大优点是
已知溴原子的原子结构示意图为
(1)溴原子的原子的序数为
(2)溴元素的原子在反应中易得到个电子,表现为性(填氧化性或还原性)
(3)溴元素的最高化合价,最低化合价。
(4)溴元素的非金属性比氯元素的非金属性(填“强”或“弱”)
(5)写出氯元素,溴元素最高价氧化物对应的水化物的化学式并比较他们的酸性强弱
(14分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素是________;Y元素是________;Z元素是:________。
(2)XZ3化合物的分子式是_________,电子式是_________。
(3)分别写出X、Y的含氧酸的分子式_________、_________。
电子层数相同的元素随着原子序数的递增,原子半径依次_______,核电荷数依次______,(填增加或减少)核对最外层电子的引力依次______,原子失去电子的能力逐渐______,得电子的能力逐渐_____,所以金属性依次_______,非金属性依次__________。
(填增强或减弱)