氯气及其化合物在工农业生产和人类生活中都有着重要的应用。
(1)Ca(ClO)2、NaClO、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 性,请写出工业上用氯气与NaOH溶液反应生产消毒剂NaClO的离子方程式 。
(2)棕黄色强刺激性气体Cl2O为国际公认高效安全灭菌消毒剂之一,实验室可用潮湿的Cl2与Na2CO3反应制取少量Cl2O和NaHCO3的离子方程式 。
(3)黄色气体ClO2可用于污水杀菌和饮用水净化。
①KClO3与SO2在强酸性溶液中反应可制得ClO2,此反应的离子方程式为 。
②ClO2遇浓盐酸会生成Cl2,每生成1 mol Cl2转移电子的物质的量为 。
③ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为 。
(4)用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应4HCl+O2 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。
已知:①上述反应中,4 mol HCl被氧化放出115.6 kJ的热量。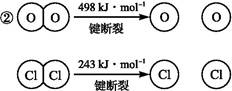
则断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
同温同压下,同体积的氨气(NH3)和硫化氢气体(H2S)的质量比为;同质量的氨气和硫化氢气体的体积比为其中含有的氢原子个数比为;若二者氢原子数相 等,它们的体积比为。
等,它们的体积比为。
某研究性学习小组对铝热反应实验 展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学
展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学 手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 |
Al |
Al2O3 |
Fe |
Fe2O3 |
| 熔点/℃ |
660 |
2054 |
1535 |
1462 |
| 沸点/℃ |
2467 |
2980 |
2750 |
- |
I.⑴某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理)
⑵设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试是_______________。
⑶实验室溶解该熔融物,下列试剂中最好的是____________ (填序号)。
(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
⑴图中OC段没有沉淀生成,此阶段发生反应的化学方程式为__________________________________。
⑵在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式是
______________________;
上述现象说明溶液中_________________结合OH-的能力比_______强(填离子符号)。
(3) B与A的差值为_________mol。B点 对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
对应的沉淀的物质的量为________mol,C点对应的氢氧化钠溶液的体积为___________mL
下列各物质是中学化学中常见的物质,甲为常见金属单质,乙、丙、丁是非金属单质,其它为化合物,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,①是实验室制取丁的反应之一,F为棕黄色溶液。各物质间的转化如下图所示,回答下列各问题(部分生成物未列出):
(1)写出乙的化学式、A的电子式、甲在周期表中位置是;
(2)写出G的一种用途;
(3)写出B与K反应的化学方程式:;
(4)整个转换过程中属于氧化还原反应的有个;
(5)写出反应③E与G按物质的量之比2:1的反应的离子方程式。
医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量。回答下列问题:
H++MnO4-+H2C2O4→CO2↑+Mn2++□
(1)配平以上离子方程式,并在□中填上所需的微粒。
(2)该反应中的还原剂是。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为mol。 (4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
(4)测定血钙的含量的方法是:取2mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液滴定。
①稀硫酸溶解CaC2O4沉淀的化学方程式是。
②溶解沉淀时(能或不能)用稀盐酸,原因是。
③若消耗了1.0×10-4mol/L的KMnO4溶液20.00mL,则100mL该血液中含钙g。
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇。已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解5mol水消耗的能量是______kJ;
(2)写出甲醇燃烧热的热化学方程式:
(3)在容积为 2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况 下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于 300℃);
下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于 300℃);
下列说法正确的是(填序号)
①温度为T2时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=nB/tBmol·L- 1·min-1
1·min-1
②该反应在T1时的平衡常数比T2时的大
③该反应为吸热反应 ④该反应为熵增加的反应
④该反应为熵增加的反应
(4)在T1温度时,将1molCO2和3molH2充入一密闭恒容器中 ,充分反应达到平衡后,若容器内的压强与起始压强之比为0.8,则平衡时甲醇的体积分数为
,充分反应达到平衡后,若容器内的压强与起始压强之比为0.8,则平衡时甲醇的体积分数为