异戊二烯(即2-甲基-1,3丁二烯)是橡胶工业的重要原料。工业上有多种合成方法,其中两种如下: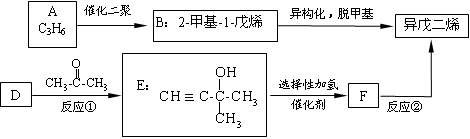
根据题意回答下列问题:
(1)A的结构简式为______________。已知D可作为生产高分子导电材料的原料,则D
的名称是______________。
(2)反应①的反应类型是____________________。
反应②的化学方程式为_____________________________________________。
(3)下列说法正确的是_____________(填字母序号)。
A.1mol E完全燃烧耗6.5 mol氧气
B.A与B、E与F分别互为同系物
C.1mol异戊二烯与1mol Br2发生加成反应,产物不只一种
D.聚乙烯、聚异戊二烯均可以使溴的四氯化碳溶液褪色
(4)烯烃复分解反应可表示如下(炔烃也能发生此类反应):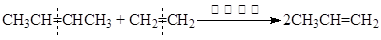
写出CH2=CH—CH2—CH2—CH2—CH2—CH=CH2发生复分解反应生成六元环的化
学方程式:___________________________________________________________。
(5)与异戊二烯相差一个“CH2”原子团,且结构中只有一个甲基的同系物除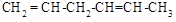 、
、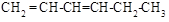 、
、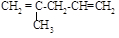 外,
外,
还有________________、_______________(填结构简式,已知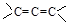 不稳定)。
不稳定)。
实验室用Na2SO4·10H2O配制500ml,0.100mol/L的Na2SO4溶液
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、、。
(2)本实验须称量硫酸钠晶体(Na2SO4·10H2O)为g。
(3)用Na2SO4·10H2O配制标准溶液的正确顺序是。
| A.冷却 | B.称量 | C.洗涤 | D.定容 E.溶解 F.摇匀 G.移液 |
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)
①没有洗涤烧杯和玻璃棒。。
②定容时俯视容量瓶的刻度线。。
相同物质的量的SO2与SO3,其质量之比为,氧元素的质量之比为,原子总数之比为。
某金属氯化物MCl2质量为33.3g,含有0.6molCl—,其中M2+的个数约为,该氯化物的摩尔质量为,金属M的相对原子质量为。
在标准状况下有:① 0.3mol氨气②6.02×1022个H2O分子 ③7.3gHCl④ 0.2molCH4。请将序号填在后面横线上,
体积最大的是;密度最大的是;质量最大的是。
用①质子数、②中子数、③电子数、④质量数、⑤同位素填空,
请将序号填在后面横线上。
(1)136C与147N具有相同的,(2)136C与126C具有相同的,
(3)146C与147N具有相同的,(4)157N与147N互为。