(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题: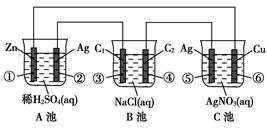
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
实验室配制FeSO4溶液通常需要加入少量稀硫酸与铁屑。完成下列填空:
(1)加入铁屑的目的是: ;加入稀硫酸的目的是: 。
(2)有一瓶未加稀硫酸与铁屑的FeSO4溶液,在空气中放置一段时间后,溶液颜色变黄且有红褐色浑浊。写出并配平上述变化的化学反应方程式:__________________
(3)上述反应中的还原产物是: 。
(4)现有1.2L含3mol FeSO4的溶液恰好与0.6 mol HIO3完全反应,则还原产物是 。如果改用HBrO3恰好与上述FeSO4的溶液反应,则最少消耗的HBrO3 (填“大于”、“小于”或“等于”) 0.6 mol。理由是 。
工业生产硝酸铵的流程图如下:请回答下列问题:
(1)写出硝酸铵在工农业生产中的重要作用_______________(任写一条)。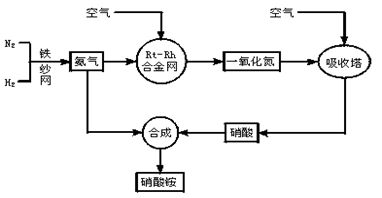
(2)已知N2(g)+3H2(g) 2NH3(g),ΔH=-92.4 kJ·mol-1。
2NH3(g),ΔH=-92.4 kJ·mol-1。
在一定温度压强和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量___________(填“<” “>” “=”)92.4kJ,理由是 。
(3)写出氨催化氧化的化学方程式:__________________________。
在某无色溶液里,只含有下列8种离子中的某几种:Na+、H+、Ag+、Mg2+、Cl-、OH-、HCO3—、NO3—。已知该溶液能跟铝粉反应,且放出的气体只有H2。试回答:
(1)若溶液和铝粉反应后有AlO2-生成,则溶液中一定含有大量的_____________离子,还可能含有大量的________离子。
(2)若溶液和铝粉反应后有Al3+生成则溶液中一定含有大量的________离子,原溶液中一定不含有大量的________离子。
四川盛产五倍子。以五倍子为原料可以制得化合物A。A的结构简式如下图所示: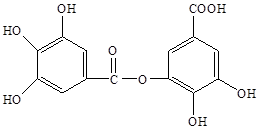
请回答下列问题:
(1)A中有哪些官能团(写出名称)_______。
(2)有机物B在硫酸催化条件下加热发生酯化反应可得到A。请写出B的结构简式_________。
(3)1molA最多能消耗 molNaOH;请写出A与过量的NaOH溶液反应的化学方程式________。
(4)有机化合物C是合成治疗禽流感药物的原料之一。C可以看做是B与氢气按物质的量之比1:2发生加成反应得到的产物。C分子中无羟基与碳碳双键直接相连的结构,它能使溴水褪色。请写出C与溴水反应的化学方程式________。
有A、B、C、D 4种烃,各取0.01 mol充分燃烧后,B、C、D所产生的二氧化碳均为448 mL(标准状况);A燃烧所得的二氧化碳是其他三者的3倍。在镍催化剂的作用下,A、B、C都能和氢气发生加成反应,B可以转变为C或D,C可以转变为D;B或C都能使酸性高锰酸钾溶液褪色,而A、D无此性质;在FeBr3存在时,A与液溴发生取代反应。
试推断出4种烃的结构简式:
(1)A是 ,B是 ,C是 ,D是 。
(2)B→D的反应方程式: 。
(3)除去D中C的反应方程式: 。
(4)C发生加聚反应的方程式: 。