高中化学学习过程中的物质颜色是需要注意的。下列关于颜色的描述正确的个数是
① 氯水放久了会逐渐由黄绿色变成几乎无色
② AgBr见光分解会生成浅黄色的银
③ KI溶液中加入淀粉溶液会变成蓝色
④ 溴水中加入CCl4振荡静置后,CCl4层无色
⑤ 钾元素的焰色反应透过蓝色的钴玻璃观察呈紫色
| A.1个 | B.2个 |
C.3个 | D.4个 |
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
| A.升高温度,平衡正向移动,醋酸的电离常数Ka值增大 |
| B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D.25℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸 |
下列说法正确的是
| A.pH<7的溶液一定是酸性溶液 |
| B.室温时,pH=5的溶液和pH=3的溶液相比,前者c(OH-)是后者的100倍 |
| C.室温下,每1×107个水分子中只有一个水分子发生电离 |
| D.HCl溶液中无OH-,NaOH溶液中无H+,NaCl溶液中既无OH-也无H+ |
在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g) + bB(g) xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
xC(g),符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指
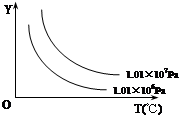
A.反应物A的百分含量B.反应物B的平衡转化率
C.平衡混合气的密度D.平衡混合气的总物质的量
某恒温密闭容器中,可逆反应A(s) 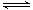 B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
B+C(g) ΔH="Q" kJ·mol-1(Q>0 ),达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析不正确的是
| A.产物B的状态可能为固态或液态 |
| B.平衡时,单位时间内A和B消耗的物质的量之比为1:1 |
| C.保持体积不变,向平衡体系中加入A(s),平衡不移动 |
| D.若开始时向容器中加入1molB和1molC,达到平衡时放出热量Q kJ |
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是
2Z(g),在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是
| A.T1<T2,正反应是放热反应 | B.T1<T2,正反应是吸热反应 |
| C.T1>T2,正反应是放热反应 | D.T1>T2,正反应是吸热反应 |