以下说法正确的是
| A.物质所含元素化合价升高的反应叫还原反应 |
| B.金属阳离子在氧化还原反应中不一定作氧化剂, |
| C.含非金属元素的离子,在氧化还原反应中作还原剂 |
| D.非金属原子越容易得到电子,其单质还原性越强; |
一定条件下,对于可逆反应X(g)+3Y(g)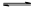 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是()
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断不合理的是()
A.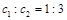 |
B. X、Y的转化率相等 X、Y的转化率相等 |
C.平衡时,Y和Z的生成速率之比为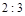 |
| D.c1的取值范围为0< c1<0.14 mol·L-1 |
常温下,下列溶液中一定能大量共存的离子组是
| A.与金属铝反应能放出氢气的溶液:NH4+、NO3-、CO32-、Na+ |
| B.无色澄清溶液:K+、NO3-、SO42-、Fe3+ |
| C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+ |
| D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+ |
下列变化属于水解反应的是( )
①NH3+H2O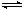 NH4++OH-
NH4++OH- ②HCO3-+H2O
②HCO3-+H2O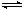 H2CO3+OH-
H2CO3+OH-
③NH4++2H2O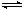 NH3·H2O+H3O+④Al3++3HCO3-=Al(OH)3↓+3CO2↑
NH3·H2O+H3O+④Al3++3HCO3-=Al(OH)3↓+3CO2↑
⑤AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- ⑥HCO3-+H2O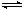 H3O++CO32-
H3O++CO32-
| A.②③⑤ | B.②③④ | C.②④⑥ | D.①③④ |
已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);ΔH=-24.2 kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2 L的密闭容器中,其中物质的浓度随时间变化的关系如下图所示。下列推理分析合理的是( )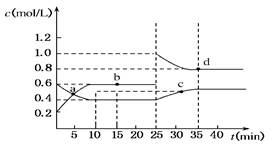
| A.反应进行到10 min时,体系吸收的热量为9.68 kJ |
| B.前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L·min) |
| C.a、b、c、d四点中v正与v逆均相等 |
| D.25 min时,导致平衡移动的原因是升温 |
下列说法不正确的是
| A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 |
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为α,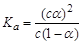 。若加入少量醋酸钠固体,则CH3COOH 。若加入少量醋酸钠固体,则CH3COOH CH3COO-+H+向左移动,α减小,Ka变小 CH3COO-+H+向左移动,α减小,Ka变小 |
| C.0.1 mol·L-1的碳酸钠溶液的pH大于0.1 mol·L-1的醋酸钠溶液的pH |
D.已知:Fe2O3(s)+3C (石墨) (石墨) 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 2Fe(s)+3CO(g),△H=+489.0 kJ/mol。 |
CO(g)+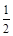 O2(g)
O2(g) CO2(g),△H=-283.0 kJ/mol。
CO2(g),△H=-283.0 kJ/mol。
C(石墨)+O2(g) CO2(g),△H=-393.5 kJ/mol。
CO2(g),△H=-393.5 kJ/mol。
则4Fe(s)+3O2(g) 2Fe2O3(s),△H=-1641.0 kJ/mol
2Fe2O3(s),△H=-1641.0 kJ/mol