(10分)、Ⅰ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%一30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。
Ⅱ:探究家庭制备次氯酸钠溶液的发生器如右图,原理是用石墨做电极电解饱和食盐水。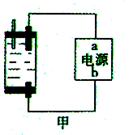
(1)若通电后,为使氯气被全部吸收,则电源的a极的名称是 。
(2)电解饱和食盐水的离子方程式为 ,所得的次氯酸钠溶液中加入几滴石蕊试液,观察到的现象是 ,
用离子方程式和简要文字说明理由 。
请完成下列各题:
(1)下面列出了几组物质:
①金刚石与石墨;②D与T;③12C和13C;
④O2与O3;⑤CH4和CH3CH2CH3;⑥CH2=CH2和CH2=CHCH3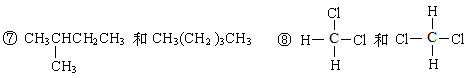
⑨ CH3CH2OCH2CH3和 CH3CH2CH2CH2OH
其中属于同素异形体的是(填序号,下同);属于同位素的是;属于同系物的是;属于同分异构体的是。
(2)在下列反应中,属于取代反应的是(填序号,下同);属于加成反应的是;属于氧化反应的是。
①由乙烯制一氯乙烷;②乙烯使酸性高锰酸钾溶液褪色;③乙烷在光照下与氯气反应;④乙烯使溴水褪色;⑤由苯制取溴苯。
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
请回答下列问题:
(1)指出反应类型:A→B:反应;A→C:反应 ;A→E:反应
(2)在A~E五种物质中,互为同分异构体的是(填字母代号)。
(3)写出由A生成B的化学方程式
。
(4)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是(填序号)。
(5)C能形成高聚物,该高聚物的结构简式为。
(6)写出D与NaOH溶液共热反应的化学方程式。
(I)下列实验操作正确的是。
| A.在催化剂存在的条件下, 苯和溴水发生反应可生成无色、比水重的液体溴苯 |
| B.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验 |
| C.醇中含有少量水可加入生石灰再蒸馏制得无水乙醇 |
| D.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,然后加热制取乙酸乙酯 |
E.实验室制取乙烯时,放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动
F.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
G.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合,充分振荡溶液、静置、待液体分层后,滴加硝酸银溶液
H.在浓苯酚溶液中滴入几滴稀溴水,马上可以看到白色沉淀
I.1mol·L-1CuSO4溶液2mL和0.5mol·L-1NaOH溶液4mL混合后加入40%的乙醛溶液,加热煮沸观察砖红色沉淀的产生
O3能吸收有害紫外线,保护人类赖以生存的空间。O3分子的结构如图,呈V型,键角116.5℃。三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键——三个O原子均等地享有这4个电子。请回答: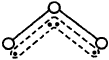
O3的分子结构
(1)臭氧与氧气的关系是___________。
(2)选出下列分子中与O3分子属于等电子体的是。
| A.H2O | B.CO2 | C.SO2 | D.BeCl2 |
(3)分子中某原子有1对没有跟其他原子共用的价电子叫孤对电子,那么O3分子有_______对孤对电子。
(4)O3与O2间的转化是否为氧化还原反应___________。
A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A 、E在周期表中处于同一纵行。己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B可以组成最简单的有机物,B与C可以组成两种中学化学中常见的气体;
③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1) A为元素,B为元素,C为元素,
D为元素,E为元素 (填元素名称)。
(2) C元素在周期表中属周期族元素,原子结构简图为。
(3) 用电子式表示D与E形成化合物的过程____________________________________,D与B形成的化合物的电子式.