A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A 、E在周期表中处于同一纵行。己知:
①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;
②A与B可以组成最简单的有机物,B与C可以组成两种中学化学中常见的气体;
③D与E生成离子化合物,其离子的电子层结构相同。回答:
(1) A为 元素,B为 元素,C为 元素,
D为 元素,E为 元素 (填元素名称)。
(2) C元素在周期表中属 周期 族元素,原子结构简图为 。
(3) 用电子式表示D与E形成化合物的过程____________________________________,D与B形成的化合物的电子式 .
某实验小组用以下几个实验装置探究电化学过程对金属与稀硫酸反应速率的影响, 烧杯中都盛有稀H2SO4。
试回答:
(1)B装置中Cu电极上的电极反应式为,D装置中Fe电极上的电极反应式为;
(2)D装置中的实验现象有,若用电流表测量反应时通过导线的电子流量为0. 2mol,则Fe电极的质量变化为;
(3)比较四个装置中Fe片被腐蚀的速率由快到慢的顺序是(用A、B、C、D表示)。
“西气东输”是西部开发的重点工程,这里的“气”是指天然气,其主要成分是甲烷。水煤气中主要成分是CO和H2,二者的体积比为l :l。已知:在120℃和一个大气压下,H-H键能为436 kJ/mol,O=O键能为496 kJ/mol,H-O键能为463 kJ/mol ;1 mol CO气体完全燃烧生成CO2气体放出283 kJ热量;l mol CH4气体完全燃烧生成CO2气体和气态水放出802 kJ热量。
(1)写出120℃和一个大气压下,H2完全燃烧生成气态水的热化学方程式;
(2)相同条件下,若l mol CH4气体完全燃烧生成CO2气体和液态水,放出的热量802 kJ;(选填“>”、“=”、“<”)
(3)忽略水煤气中其他成分,燃烧等体积的CH4和水煤气,所得热量之比约为;
(4)请结合以上计算结果,叙述相比于水煤气,天然气作为燃料的两个优点:
。
某学生为了探究Zn与盐酸反应过程中的速率变化,在100mL稀盐酸中加入足量的Zn粉,用排水集气法收集反应放出的H2,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大,你认为原因是;
(2)4~5 min时间段的反应速率最小,你认为原因是; (3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=;
(3)求2~3 min时间段内以盐酸的浓度变化来表示的反应速率(假设溶液体积保持不变)V(HCl)=;
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
| A.H2O | B.NaCl溶液 | C.Na2CO3溶液 | D.Cu粉E.CuSO4粉末; |
你认为可行的是(填编号)。
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。
请回答下列问题: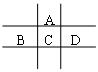
(1)B元素在周期表中的位置为;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是,最后阶段反应的离子方程式为 ;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示)。
有下列一组物质:He、Cl2、CH4、Na2O2、Ba(OH)2、NO2、KNO3、H2SO4,请从中选择,用化学式填写下列空白:
(1)只含有共价键,不含其他化学键的化合物有;
(2)既含有共价键又含有离子键的物质有;
(3)能在水中发生氧化还原反应的有。